题目内容
19.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol/L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是( )| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
分析 NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,
两溶液中发生的过程相似,①溶质电离:NaHRO3=Na++HRO3-,②HRO3-电离:HRO3-?H++RO32-,
③HRO3-水解:HRO3-+H2O?H2RO3+OH-,④水电离:H2O?H++OH-.
由溶液呈电中性有电荷守恒关系(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);
据化学式NaHRO3得物料守恒关系(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);
(a)-(b)得质子守恒关系(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-).
对NaHSO3溶液,过程②的程度大于③,有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
对NaHCO3溶液,过程③的程度大于②,有c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+).
同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-).
解答 解:A.NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故A错误;
B.由溶液呈电中性有电荷守恒关系:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C.根据化学式NaHRO3得物料守恒关系:c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),故C正确;
D.同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-),故D错误;
故选C.
点评 本题考查离子浓度的大小比较,题目难度较大,注意从守恒的角度分析,还要注意题目要求,即“浓度均为浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液中均存在的关系”此为解答该题的关键之处,试题培养了学生的分析、理解能力及灵活应用能力.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:2H2(g)+O2(g)═2H2O(g) K12C(s)+O2(g)=2CO (g) K2
2C(s)+2H2O(g)═2CO(g)+2H2(g)则K=$\sqrt{\frac{{K}_{2}}{{K}_{1}}}$(用含K1、K2的式子表示).
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |
| A. | 氧化剂和还原剂的物质的量比为8:3 | |
| B. | 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2:3 | |
| C. | 生成1molNO气体转移的电子数为3NA | |
| D. | 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物 |
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
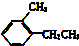 ②
② ③
③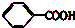 ④TNT
④TNT