题目内容
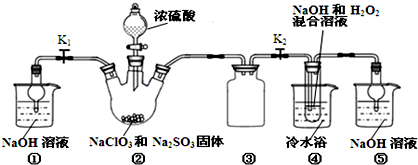
 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:①氢氧燃料电池中,正极的电极反应式为
②如图装置中,某一铜电极的质量减轻3.2g,则A极上消耗的O2在标况下的体积为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①碱性氢氧燃料电池中,正极上氧气得电子发生还原反应;
②串联电路中转移电子数相等,一铜电极的质量减轻3.2g,应为阴极,发生Cu-2e-=Cu2+,据此计算消耗氧气的体积.
②串联电路中转移电子数相等,一铜电极的质量减轻3.2g,应为阴极,发生Cu-2e-=Cu2+,据此计算消耗氧气的体积.
解答:
解:①碱性氢氧燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②阳极上铜失电子生成铜离子进入溶液,发生发生Cu-2e-=Cu2+,溶解的铜的物质的量=
=0.05mol,失去电子的物质的量=0.05mol×2=0.1mol,串联电路中,转移电子相等,由电极方程式O2+2H2O+4e-=4OH-可知消耗氧气的体积=
×22.4L/mol=0.56L,
故答案为:0.56.
②阳极上铜失电子生成铜离子进入溶液,发生发生Cu-2e-=Cu2+,溶解的铜的物质的量=
| 3.2g |
| 64g/mol |
| 0.1mol |
| 4 |
故答案为:0.56.
点评:本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析、计算能力的考查,明确原电池正负极的判断方法、电极反应式是解本题关键,难度中等.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
下列离子方程式中正确的是( )
| A、碳酸氢钙溶液中加入过量氢氧化钠Ca2-+2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe2++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+2NH4++2H2O |
| D、Na2S溶液呈碱性:S2-+H2O=HS-+OH- |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某元素,它们之间具有如下转化关系:甲
乙
丙.下列有关物质的推断不正确的是( )
| 丁 |
| 丁 |
| 甲 |
| A、若甲为C2H5OH,则丙可能为CH3COOH |
| B、若涉及反应均为氧化还原反应,则甲可能为Cl2 |
| C、若涉及反应均为氧化还原反应,则丁可能为O2 |
| D、若甲为AlCl3溶液,则丁可能是NaOH溶液 |



 结构的酯类中共有6种(即X有不同的结构),请写出其中的二种
结构的酯类中共有6种(即X有不同的结构),请写出其中的二种