题目内容
下列离子方程式中正确的是( )
| A、碳酸氢钙溶液中加入过量氢氧化钠Ca2-+2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe2++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+2NH4++2H2O |
| D、Na2S溶液呈碱性:S2-+H2O=HS-+OH- |
考点:离子方程式的书写
专题:
分析:A.氢氧化钠过量,离子方程式按照碳酸氢钙的化学式组成书写,碳酸根离子有剩余;
B.反应生成的铁离子能够将碘离子氧化成碘单质;
C.氨水碱性较弱,不会溶解氢氧化铝,二者反应生成氢氧化铝沉淀;
D.硫离子的水解分步进行,水解方程式需要分步写,主要以第一步为主,水解程度较小,水解方程式应该用可逆号.
B.反应生成的铁离子能够将碘离子氧化成碘单质;
C.氨水碱性较弱,不会溶解氢氧化铝,二者反应生成氢氧化铝沉淀;
D.硫离子的水解分步进行,水解方程式需要分步写,主要以第一步为主,水解程度较小,水解方程式应该用可逆号.
解答:
解:A.碳酸氢钙溶液中加入过量氢氧化钠,反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:Ca2-+2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故A正确;
B.氧化铁可溶于氢碘酸,二者发生氧化还原反应,正确的离子方程式为:Fe2O3+2I-+6H+=2Fe2++I2+3H2O,故B错误;
C.AlCl3溶液中加入过量的浓氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.硫化钠溶液呈碱性,原因是硫离子的水解,正确的水解离子方程式为:S2-+H2O?HS-+OH-,故D错误;
故选A.
B.氧化铁可溶于氢碘酸,二者发生氧化还原反应,正确的离子方程式为:Fe2O3+2I-+6H+=2Fe2++I2+3H2O,故B错误;
C.AlCl3溶液中加入过量的浓氨水,反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.硫化钠溶液呈碱性,原因是硫离子的水解,正确的水解离子方程式为:S2-+H2O?HS-+OH-,故D错误;
故选A.
点评:本题考查了离子方程式的书写判断,题目难度中等,注意熟练掌握离子方程式的书写原则,明确氧化还原反应型的离子方程式的书写方法,为易错点,选项D需要明确硫离子的水解分步进行,且为可逆反应.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列叙述正确的是( )
| A、只含一种元素的物质,可能为混合物 | ||
| B、非金属元素都是主族元素,最外层电子数都大于或等于3 | ||
C、
| ||
| D、工业由N2制备氨气以及由NH3氧化制备硝酸的过程都属于氮的固定 |
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品--三聚氰酸,反应的化学方程式如下:NH3+CO2→ +H2O下列有关三聚氰酸的说法正确的是( )
+H2O下列有关三聚氰酸的说法正确的是( )
 +H2O下列有关三聚氰酸的说法正确的是( )
+H2O下列有关三聚氰酸的说法正确的是( )| A、分子式为C3H6N3O3 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种.
(1)取该溶液少量滴加足量氯水后,有气泡产生、溶液呈橙黄色;
(2)向呈橙黄色的溶液中加入氯化钡溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉溶液变蓝.根据上述事实推断,在原溶液中肯定都存在的离子组是( )
(1)取该溶液少量滴加足量氯水后,有气泡产生、溶液呈橙黄色;
(2)向呈橙黄色的溶液中加入氯化钡溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉溶液变蓝.根据上述事实推断,在原溶液中肯定都存在的离子组是( )
| A、Na+、Br-、CO32- |
| B、Na+、I-、SO32- |
| C、Fe2+、I-、SO32- |
| D、Fe2+、Br-、CO32- |
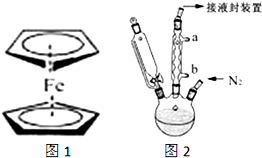 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验: