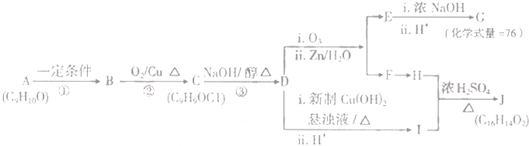
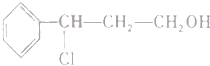题目内容
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g)?2SO3(g)达到平衡状态
①在温度不变的条件下,加入2molSO2(g)和2molO2(g),平衡后,SO3(g)的体积分数为30%,若相同条件投入1molSO2(g),xmolO2(g)和ymolSO3(g),平衡后SO3(g)的体积分数也为30%,则x= y= .
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g)?2SO3(g)达到平衡状态
①在温度不变的条件下,加入2molSO2(g)和2molO2(g),平衡后,SO3(g)的体积分数为30%,若相同条件投入1molSO2(g),xmolO2(g)和ymolSO3(g),平衡后SO3(g)的体积分数也为30%,则x=
考点:化学平衡的计算
专题:化学平衡专题
分析:因为平衡2SO2+O2?2SO3是反应前后气体体积减小的反应,所以在恒温恒容条件下,平衡后SO3(g)的体积分数为30%,则该平衡和原平衡为完全等效,即都折算成反应后有关物质的物质的量要完全相等,据此计算.
解答:
解:若在相同条件投入1molSO2(g),xmolO2(g)和ymolSO3(g),平衡后SO3(g)的体积分数也为30%,说明两个平衡在恒温恒容条件下为完全等效平衡,则将1molSO2(g),xmolO2(g)和ymolSO3(g)的量完全转化到反应物,使SO2、O2的量分别等于2mol和1mol
2SO2 +O2 ?2SO3
起始量(mol) 1 x y
完全转化(mol)1+y x+
0
故:1+y=2;x+
=2;解得x=1.5、y=1,
故答案:1.5;1.
2SO2 +O2 ?2SO3
起始量(mol) 1 x y
完全转化(mol)1+y x+
| y |
| 2 |
故:1+y=2;x+
| y |
| 2 |
故答案:1.5;1.
点评:本题考查化学平衡中等效平衡的计算,本题难度不大,注意等效平衡的理解和应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种.
(1)取该溶液少量滴加足量氯水后,有气泡产生、溶液呈橙黄色;
(2)向呈橙黄色的溶液中加入氯化钡溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉溶液变蓝.根据上述事实推断,在原溶液中肯定都存在的离子组是( )
(1)取该溶液少量滴加足量氯水后,有气泡产生、溶液呈橙黄色;
(2)向呈橙黄色的溶液中加入氯化钡溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉溶液变蓝.根据上述事实推断,在原溶液中肯定都存在的离子组是( )
| A、Na+、Br-、CO32- |
| B、Na+、I-、SO32- |
| C、Fe2+、I-、SO32- |
| D、Fe2+、Br-、CO32- |
 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
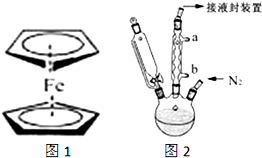
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验: