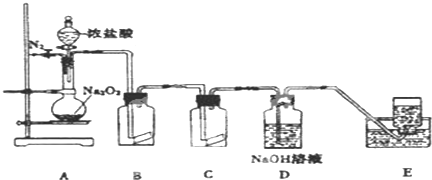
题目内容
对于反应KClO3+HCl=KC1+Cl2↑+H2O(未配平)若有0.1mol KClO3 参加反应,下列说法正确的是( )
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |
考点:氧化还原反应
专题:
分析:KClO3+HCl=KC1+Cl2↑+H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答:
解:A.0.1mol KClO3 参加反应,转移电子为0.1mol×(5-0)=0.5mol,故A正确;
B.由电子、原子守恒可知,反应为KClO3+6HCl=KC1+3Cl2↑+3H2O,则有0.1mol KClO3 参加反应,生成0.3 mol Cl2,故B错误;
C.由电子守恒可知,被氧化的HC1为
=0.5 mol,故C错误;
D.只有Cl元素的化合价变化,则Cl2是只是氧化产物也是还原产物,故D错误;
故选A.
B.由电子、原子守恒可知,反应为KClO3+6HCl=KC1+3Cl2↑+3H2O,则有0.1mol KClO3 参加反应,生成0.3 mol Cl2,故B错误;
C.由电子守恒可知,被氧化的HC1为
| 0.5mol |
| (1-0) |
D.只有Cl元素的化合价变化,则Cl2是只是氧化产物也是还原产物,故D错误;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素化合价变化为解答的关键,侧重氧化还原基本概念的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA代表阿伏加德罗常数.下列说法正确的是( )
| A、2.9 g 2CaSO4?H2O中含有的结晶水分子数为0.02NA |
| B、30 g乙酸和葡萄糖的混和物中含碳原子数为NA |
| C、在铁与硫的反应中,1 mol铁失去的电子数为3NA |
| D、62 g Na2O溶于水后所得溶液中含有的O2-数为NA足量溶液A充分反应 |
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ | ||
| B、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度顺序:c(X-)>c(Y-)>c(OH-)>c(H+) | ||
| C、根据滴定曲线,可得Ka(HY)≈10-5 | ||
D、HY与HZ混合,达到平衡时:c(H+)=
|
下列实验装置设计正确,且能达到目的是( )
A、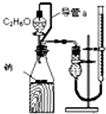 测定乙醇的结构式 |
B、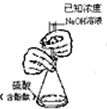 滴定法测定核酸的物质的量浓度 |
C、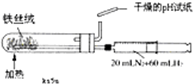 合成氨并检验氨的生成 |
D、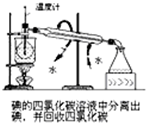 碘的四氯化碳溶液中分离出碘,并回收四氯化碳 |
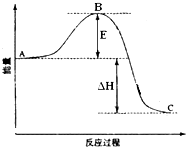 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: