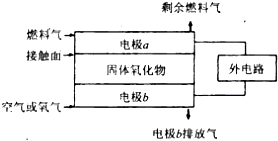
题目内容
在常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是多少?(要写计算过程)
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,结合溶液的pH和溶液体积换算物质的量列式计算
解答:
解:pH=12的Ba(OH)2溶液中C(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol;反应的硫酸氢钠物质的量为0.5x×10-2mol;设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;
所以得到:
=10-3;
得到x:y=1:4,
答:Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;
所以得到:
| x×10-2-0.5x×10-2 |
| x+y |
得到x:y=1:4,
答:Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.
点评:本题考查了酸碱反应的综合计算,溶液pH的计算应用,注意溶液中氢氧根离子浓度和溶质浓度的关系是解题关键.

练习册系列答案
相关题目
化学无处不在,下列与化学有关的说法正确的是( )
| A、蛋白质受热能发生变性,故加热能杀死流感病毒 |
| B、食品添加剂均对人体健康有害,故应禁止使用 |
| C、维生素C因具有酸性,故可做抗氧化剂 |
| D、明矾因有净水作用,故可淡化海水 |
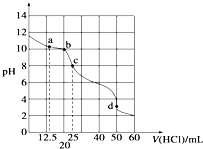 在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A、a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B、b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C、c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
| A、496 kJ?mol-1 |
| B、248 kJ?mol-1 |
| C、428 kJ?mol-1 |
| D、284 kJ?mol-1 |
下列微粒对CH3COO-+H2O?CH3COOH+OH-水解平衡有影响的是( )
| A、H2O |
B、 |
| C、NO3- |
| D、Ba2+ |
硫-钠原电池具有输出功率较高,循环寿命长等优点.其工作原理可表示为:2Na+xS
Na2Sx.但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(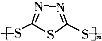 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
| 放电 |
| 充电 |
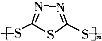 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(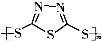 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(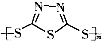 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 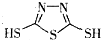 转化为 转化为 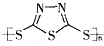 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
对于反应KClO3+HCl=KC1+Cl2↑+H2O(未配平)若有0.1mol KClO3 参加反应,下列说法正确的是( )
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |