题目内容
设NA代表阿伏加德罗常数.下列说法正确的是( )
| A、2.9 g 2CaSO4?H2O中含有的结晶水分子数为0.02NA |
| B、30 g乙酸和葡萄糖的混和物中含碳原子数为NA |
| C、在铁与硫的反应中,1 mol铁失去的电子数为3NA |
| D、62 g Na2O溶于水后所得溶液中含有的O2-数为NA足量溶液A充分反应 |
考点:阿伏加德罗常数
专题:
分析:A、根据质量取出2CaSO4?H2O的物质的量,再结合化学式计算;
B、依据分子结构的特征,最简式相同,元素的含量相同 分析计算.
C、注意铁与硫反应后的价态;
D、Na2O溶于水生成NaOH,则溶液中的溶质是NaOH;
B、依据分子结构的特征,最简式相同,元素的含量相同 分析计算.
C、注意铁与硫反应后的价态;
D、Na2O溶于水生成NaOH,则溶液中的溶质是NaOH;
解答:
解:A、2.9g 2CaSO4?H2O物质的量n=
=0.01mol,含有的结晶水分子数为0.01NA,故A错误;
B、乙酸和葡萄糖的最简式相同为CH2O,所以分子中的氧元素含量相同,同质量的物质含氧元素相同,所以氧元素的质量=30g×
=16g,氧原子物质的量是1mol,即30g乙酸与30g葡萄糖含有的氧原子数均为NA,故B正确;
C、铁与硫反应后生成FeS,故1mol铁失去的电子数为2NA,故C错误;
D、Na2O+H2O=2NaOH,则溶液中的溶质是NaOH,溶液中不存在O2-,故D错误;
故选B.
| m |
| M |
B、乙酸和葡萄糖的最简式相同为CH2O,所以分子中的氧元素含量相同,同质量的物质含氧元素相同,所以氧元素的质量=30g×
| 16 |
| 12+2+16 |
C、铁与硫反应后生成FeS,故1mol铁失去的电子数为2NA,故C错误;
D、Na2O+H2O=2NaOH,则溶液中的溶质是NaOH,溶液中不存在O2-,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
| A、496 kJ?mol-1 |
| B、248 kJ?mol-1 |
| C、428 kJ?mol-1 |
| D、284 kJ?mol-1 |
硫-钠原电池具有输出功率较高,循环寿命长等优点.其工作原理可表示为:2Na+xS
Na2Sx.但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(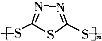 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
| 放电 |
| 充电 |
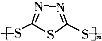 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(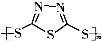 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(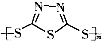 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 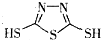 转化为 转化为 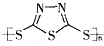 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
对于反应KClO3+HCl=KC1+Cl2↑+H2O(未配平)若有0.1mol KClO3 参加反应,下列说法正确的是( )
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、1molNa变成Na+时失去的电子数为NA |
| B、12g12C中所含12C的数目为NA |
| C、CaCl2溶液中若含有1.5NA个Ca2+,则含有3NA个Cl- |
| D、11.2LN2中含有的氮原子数目为NA |