题目内容
可逆反应A(g)+2B(g)?2C(g)(放热反应);在一定条件下达到平衡,改变条件,将变化结果(填“增大”、“减小”或“不变”),填入空格.
(1)升高温度,B的转化率 ,V正 V逆 .
(2)保持温度和压强不变,加入稀有气体,则C的物质的量 .
(3)保持温度和体积不变,再加入稀有气体,A的转化率 .
(1)升高温度,B的转化率
(2)保持温度和压强不变,加入稀有气体,则C的物质的量
(3)保持温度和体积不变,再加入稀有气体,A的转化率
考点:化学平衡的影响因素
专题:
分析:(1)该反应放热,升温平衡逆向移动,正逆反应速率增大;
(2)恒温恒压容器中加入不参与反应的稀有气体,体积增大,压强减小,反应速率减小,平衡逆向进行;
(3)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡;
(2)恒温恒压容器中加入不参与反应的稀有气体,体积增大,压强减小,反应速率减小,平衡逆向进行;
(3)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡;
解答:
解:(1)该反应放热,升温平衡逆向移动,反应物转化率降低,正逆反应速率增大,故答案为:减小;增大;增大;
(2)恒温恒压容器中加入不参与反应的稀有气体,体积增大,压强减小,反应速率减小,平衡逆向进行,C的物质的量减小;
故答案为:减小;
(3)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡,A的转化率不变;
故答案为:不变;
(2)恒温恒压容器中加入不参与反应的稀有气体,体积增大,压强减小,反应速率减小,平衡逆向进行,C的物质的量减小;
故答案为:减小;
(3)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡,A的转化率不变;
故答案为:不变;
点评:本题考查了化学平衡移动原理的分析判断,注意反应特征和移动原理的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
将足量CO2气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分反应,最后所得的固体物质是( )
| A、Na2SiO3 |
| B、Na2CO3、Na2SiO3 |
| C、Na2CO3、SiO2 |
| D、SiO2 |
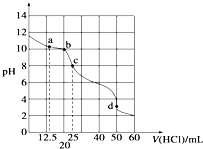 在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A、a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B、b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C、c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是( )
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
| A、496 kJ?mol-1 |
| B、248 kJ?mol-1 |
| C、428 kJ?mol-1 |
| D、284 kJ?mol-1 |
下列微粒对CH3COO-+H2O?CH3COOH+OH-水解平衡有影响的是( )
| A、H2O |
B、 |
| C、NO3- |
| D、Ba2+ |
对于反应KClO3+HCl=KC1+Cl2↑+H2O(未配平)若有0.1mol KClO3 参加反应,下列说法正确的是( )
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |
 四种短周期元素A、B、C、D的性质或结构信息如下.
四种短周期元素A、B、C、D的性质或结构信息如下.