题目内容
9.X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法正确的是( )| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | 固体Y2Z3不能从溶液中制得 | |
| D. | XW2分子中各原子最外层都达到8电子稳定结构 |
分析 X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,则X只能含有2个电子层,最外层含有2个电子,为Be元素;X与W的最外层电子数之和为9,W的最外层电子数为:9-2=7,为ⅤⅡA族元素;Y与Z的最外层电子数之和为9,五种元素均不同主族,则Y、Z的最外层电子数为3、6或4、5,再结合“其中两种为金属元素”可知Y、Z的最外层电子数只能为3、6,且Y为Al、Z为S元素,结合原子序数大小可知W为Cl元素,据此进行解答.
解答 解:X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,则X只能含有2个电子层,最外层含有2个电子,为Be元素;X与W的最外层电子数之和为9,W的最外层电子数为:9-2=7,为ⅤⅡA族元素;Y与Z的最外层电子数之和为9,五种元素均不同主族,则Y、Z的最外层电子数为3、6或4、5,再结合“其中两种为金属元素”可知Y、Z的最外层电子数只能为3、6,且Y为Al、Z为S元素,结合原子序数大小可知W为Cl元素,
A.Y为Al、W为Cl元素,铝离子含有2个电子层,氯离子含有3个电子层,则铝离子的原子半径小于W,故A错误;
B.Z为S元素,Z的氧化物对应水化物有硫酸和亚硫酸,其中亚硫酸为弱酸,故B错误;
C.Y为Al,Z为S,Y2Z3为Al2S3,Al2S3在溶液中会发生双水解反应,所以不能在溶液中稳定存在,即固体Y2Z3不能从溶液中制得,故C正确;
D.XW2为BeCl2,Be原子不满足8电子稳定结构,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意限制条件“其中两种为金属元素”,试题培养了学生的分析能力及灵活应用能力.

| X | Y | ||
| W | Z | ||
| T |
| A. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| B. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | X、Y、Z三种元素氢化物的沸点依次升高 |
| A. | O2、O3 | B. | 1H、2H+ | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | H、D、T |
| A. | CS2和NO2 | B. | N2和CO | C. | CO2和SO2 | D. | NH3和NH4+ |
| A. | 苯和水 | B. | 酒精和水 | C. | 溴苯和水 | D. | 硝基苯和水 |
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 氯化钠溶液滴入硝酸银溶液中 Ag++Cl-═AgCl↓ | |
| D. | 次氯酸钙溶液中通入少量CO2 Ca(ClO)2+CO2+H2O═CaCO3↓+2H++2ClO- |
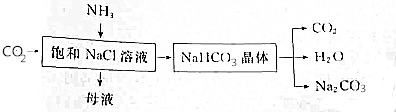
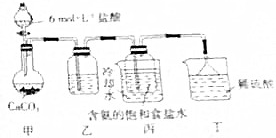
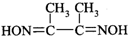 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.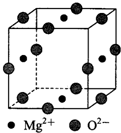
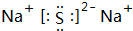 .
.