题目内容
4.丁二酮肟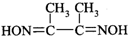 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.(1)Ni2+基态核外电子排布式为1s22s22p63s23p63d8.丁二酮肟分子中C原子轨道杂类型为sp3和sp2,1mol丁二酮肟分子所含σ键的数目为15NA.
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂.
①Ni(CO)4固态时属于分子晶体(填晶体类型).
②与CO互为等电子体的阴离子为CN-(填化学式).
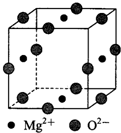
(3)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为Mg2NiO3.
分析 (1)Ni是28号元素,根据原子核外电子排布规律可知,Ni2+的基态核外电子排布式;根据价层电子对互斥理论确定中心原子杂化方式;C-H为碳氢σ键,C-C为碳碳σ键,C=N含有一个碳氮σ键;
(2)①分子晶体的熔沸点较低;②价电子数相等、原子个数相等的微粒为等电子体;
(3)利用均摊法确定晶胞的化学式.
解答 解:(1)Ni是28号元素,根据原子核外电子排布规律可知,Ni2+的基态核外电子排布式为1s22s22p63s23p63d8,甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化,已知丁二酮肟的结构式为 ,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;
,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA;
故答案为:1s22s22p63s23p63d8;sp3和sp2;15NA;
(2)①分子晶体的熔沸点较低,四羰基镍熔点-19.3℃,沸点42.1℃,所以该物质为分子晶体,
故答案为:分子;
②由第二周期主族元素组成的且与CO互为等电子体的阴离子为CN-,
故答案为:CN-;
(3)氧离子位于该晶胞的棱上,氧离子个数=$\frac{1}{4}$×12=3,所以该晶胞含有3个氧离子;镁离子处在面上,镁离子个数=$\frac{1}{2}$×4=2,该晶胞中含有2个镁离子,根据化学式中元素化合价代数和为零,该晶胞中含有1个Ni,所以该晶胞的化学式为Mg2NiO3,
故答案为:Mg2NiO3.
点评 本题考查核外电子排布规律、化学键、晶胞结构等知识,需要学生具备扎实的知识,注意利用均摊法确定晶胞的化学式,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
17.下列说法不正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应不需加热就能发生 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低 |
18.X、Y、Z均为短周期主族元素,已知它们的原子序数的关系为 X+Z=2Y,且Z的最高价氧化物对应的水化物是强酸.则下列有关说法中正确的是( )
| A. | 若X是Na,则Z 的最高价一定为偶数 | |
| B. | 若X是O,则YX一定是离子化合物 | |
| C. | 若Y是O,则非金属性:Z>Y>X | |
| D. | 若Y是Na,则X Z不可能是同一主族元素 |
15.已知在酸性条件下.氧化性BrO3->I03->Br2>I2,以下反应式错误的是( )
| A. | I-+BrO3-→IO3-+Br- | |
| B. | 6I-+BrO3-+6H+→3I2+Br-+3H2O | |
| C. | 5I-+6BrO3-+6H+→3Br2+5I03-+3H20 | |
| D. | 5I-+2BrO3-+6H+→Br2+I03-+2I2+3H20 |
2.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法,不正确的是( )
| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
9.X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法正确的是( )
| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | 固体Y2Z3不能从溶液中制得 | |
| D. | XW2分子中各原子最外层都达到8电子稳定结构 |
16.如图所示为立方烷(cunane)的球棍模型,下列有关说法不正确的是( )
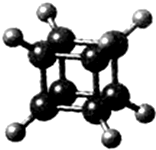

| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它二氯代物有三种同分异构体 | |
| C. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
14.用价层电子对互斥理论预测SO2和NO3-的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |