题目内容
20.纯碱是重要的化工原料,可用于制造玻璃、洗涤剂、耐火材料及水处理剂等.(1)从物质分类看,纯碱属于b(填标号).
a.碱 b.盐 c.电解质 d.混合物
(2)侯氏制碱法主要反映过程如下:
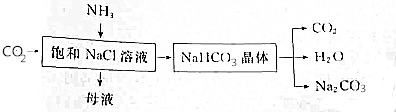
①过程中生成NaHCO3的化学方程式为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl.
②母液中存在的阴离子除OH-外,还有NH4+、Cl-.
③除去所得纯碱样品粉末分解的NaHCO3可选用的试验方法是d(填标号).
a,加适量NaOH b.加适量盐酸
c.暴露于空气一段时间 d.加热至质量不再减少
(3)化学兴趣小组的同学根据上述侯氏制碱法生产纯碱的反应原理,设计方案并在实验室进行碳酸氢钠的制备实验.实验装置如右图所示.
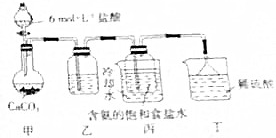
①乙装置中的试剂是饱和碳酸氢钠溶液.
②丁装置中稀硫酸的作用是吸收丙中逸出的NH3,防止污染空气.
③若用3mol•L-1H2SO4溶液代替6mol•L-1盐酸,生产的CO2的速率变慢,请分析原因:生成硫酸钙微溶,覆盖在碳酸钙表面阻止反应进一步进行.
(4)取碳酸氢钠受热分解一段时间后的固体12.28g,加水溶解,然后与足量的澄清石灰水反应,所得沉淀经洗涤、干燥后称得质量为12.00g.
分析 (1)碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子和酸根离子组成的化合物;纯净物由一种物质组成,混合物由两种或两种以上的物质组成;电解质是指:在水溶液中或熔融状态下能够导电的化合物;
(2)反应流程:氨气极易溶于水,二氧化碳在水中的溶解度较小,向氨化的饱和食盐水中通入二氧化碳气体析出碳酸氢钠,碳酸氢钠受热分解制得碳酸钠;
①氨气、水、二氧化碳反应生成碳酸氢钠、氯化铵;
②母液中含有铵根离子、氯离子;
③根据除杂原则,不能引入新的杂质;
(3)①依据制取二氧化碳时常会含有氯化氢气体,选择能和氯化氢反应但是不和二氧化碳反应的物质来除杂即可;
②依据稀硫酸能与氨气反应,氨气有毒易造成污染分析解答;
③稀硫酸代替稀盐酸,生成微溶的硫酸钙,反应速率减慢.
解答 解:(1)纯碱是碳酸钠的俗称,是由钠离子和碳酸根组成的化合物,属于盐,
故选b;
(2)①工业上以NaCl、NH3、CO2等为原料,先制得NaHCO3,进而生产出纯碱,氨气、水、二氧化碳反应生成碳酸氢钠,反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
②依据NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl可知母液中除了氨水电离出的氢氧根离子还有氯化铵电离出的铵根离子、氯离子,
故答案为:NH4+、Cl-;
③a.加适量NaOH,虽能将碳酸氢钠反应生成碳酸钠,但控制加入的氢氧化钠恰好不易控制,故不选;
b.加适量盐酸,盐酸和碳酸钠、碳酸氢钠都反应,故不选;
c.暴露于空气一段时间,碳酸钠会部分转化为碳酸氢钠,故不选;
d.加热至质量不再减少,碳酸钠受热分解生成碳酸钠、水、二氧化碳,能除去碳酸钠中的碳酸氢钠,故选;
故答案为:d;
(3)①利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过饱和碳酸氢钠的溶液是为了除掉气体中的氯化氢气体,
故答案为:饱和碳酸氢钠溶液;
②实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,防止造成污染,
故答案为:吸收丙中逸出的NH3,防止污染空气;
③稀硫酸与块状石灰石反应生成微溶于水的硫酸钙,会覆盖在石灰石表面,阻止反应的进行,
故答案为:生成硫酸钙微溶,覆盖在碳酸钙表面阻止反应进一步进行.
点评 本题考查了工业制纯碱的流程和原理,此题是一道实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强,对训练学生良好地思维品质以及知识的严密性有较好的帮助,题目难度中等.

| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |
| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(Z+m)mol 电子 | ||
| C. | $\frac{a}{A+m}$(A-Z+m)mol 中子 | D. | $\frac{a}{A}$mmolHmX |
| A. | I-+BrO3-→IO3-+Br- | |
| B. | 6I-+BrO3-+6H+→3I2+Br-+3H2O | |
| C. | 5I-+6BrO3-+6H+→3Br2+5I03-+3H20 | |
| D. | 5I-+2BrO3-+6H+→Br2+I03-+2I2+3H20 |
(1)选择试剂以除去下表所列的可溶性杂质
| 杂质 | 加入的试剂 |
| 硫酸盐 | ①BaCl2 |
| MgCl2 | ②NaOH |
| CaCl2 | ③Na2CO3 |
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-,其中盐酸除去CO32-的离子方程式为CO32-+2H+=H2O+CO2↑.
(4)最后蒸发结晶操作时,玻璃棒的作用是搅拌,防止局部过热使液体飞测;,当看到有大量固体析出,或者仅余少量液体时时,应停止加热,用余热蒸干.
| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | 固体Y2Z3不能从溶液中制得 | |
| D. | XW2分子中各原子最外层都达到8电子稳定结构 |
| A. | NO | B. | NO2 | C. | N2 | D. | N2O |
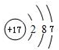 ,写出化合物E2B2的电子式
,写出化合物E2B2的电子式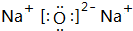 ,C在周期表中的位置第三周期VIA族.
,C在周期表中的位置第三周期VIA族. 某研究小组为了探究甲烷和氯气反应的情况,请填空:
某研究小组为了探究甲烷和氯气反应的情况,请填空: