题目内容
3.下列说法正确的是( )| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大 |
分析 A.滴入最后一滴高锰酸钾溶液,过量可判断滴定终点;
B.Na2S2O3溶液与稀硫酸反应生成S、二氧化硫,二氧化硫溶于水;
C.润洗后,从滴定管的下口放出;
D.滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,消耗标准液偏少.
解答 解:A.当Na2SO3被消耗完毕时,再滴加高锰酸钾溶液则出现紫色,所以终点时溶液由无色变为紫色,且半分钟不变色,故A错误;
B.Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,虽说也有SO2产生,但SO2在水中溶解度比较大,1体积水大约可以溶解40体积SO2,观察气体产生快慢不明显,通常用观察沉淀生成,比较不同条件下Na2S2O3溶液与稀硫酸的反应速率,故B错误;
C.润洗后,从滴定管的下口放出,不能从上口倒出,其他操作均合理,故C正确;
D.滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,消耗标准液偏少,则测定结果将偏小,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、滴定原理及应用、反应速率比较等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
11.硫代硫酸钠俗称保险粉,又名“大苏打”.可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂.
Ⅰ.已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
下列有关说法正确的是AD
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
Ⅰ.已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
8.下列说法正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH值 | |
| C. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| D. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
12.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | B元素所形成的单质的晶体类型都是相同的 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
13.下列离子组能在溶液中大量共存的是( )
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、H+、SO42-、OH- | ||
| C. | Al3+、NH4+、OH-、Cl- | D. | Ca2+、Na+、Cl-、CO32- |
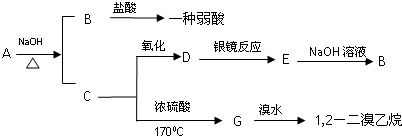
 2CH3CHO+2H2O.
2CH3CHO+2H2O.