题目内容
12.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | B元素所形成的单质的晶体类型都是相同的 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
分析 A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,故E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl,据此解答.
解答 解:A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,故E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl.
A.实验室用MnO2和HCl来制备氯气,工业上电解饱和食盐水制备氯气,故A错误;
B.碳元素单质可以组成金刚石、石墨、C60等,金刚石属于原子晶体,而C60属于分子晶体,故B错误,
C.F所形成的氢化物HCl,酸性强于碳酸,不能说明Cl的非金属性强于C,如HF属于弱酸,硫酸属于强酸,故C错误;
D.可以形成COCl2这种化合物,结构式为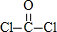 ,故D正确,
,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重于考查学生对所学知识点综合应用能力,难度中等.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
3.下列说法正确的是( )
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大 |
20.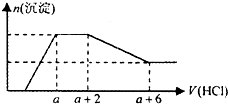 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )| A. | 原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32- | |
| B. | 反应最后形成的溶液中的溶质只有NaCl | |
| C. | 原溶液中一定含有Na2SO4 和NaOH | |
| D. | 原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
7.实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4),其过程如下:下列选项正确的是( )


| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用蒸馏水吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发结晶、冷却、过滤、洗涤 |
17.Ca(OH)2在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
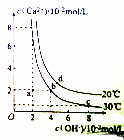

| A. | 20℃时,Ca(OH)2溶解度大于30℃时,Ca(OH)2的溶解度 | |
| B. | 30℃时,Ca(OH)2的饱和溶液中加入少量NaOH固体,Ca(OH)2的Ksp不变 | |
| C. | 30℃时,Ca(OH)2的Ksp等于3.2×10-5 | |
| D. | 20℃时,向Ca(OH)2的饱和溶液中加入少量CaO固体并维持温度不变,溶液的pH增大 |
4.在强酸性溶液中可以大量共存的离子组是( )
| A. | K+、NO3ˉ、HCO3ˉ、Clˉ | B. | SO42-、Mg2+、Clˉ、Na+ | ||
| C. | SO42-、Na+、Mg2+、CH3COOˉ | D. | Clˉ、AlO2ˉ、K+、NH4+ |
1.下列叙述正确的是( )
| A. | 1mol任何气体的气体摩尔体积都约为22.4L/mol | |
| B. | 常温常压下,11.2LO3中所含氧原子个数等于1.5NA | |
| C. | 标准状况下,1mol CCl4所占的体积约为22.4L | |
| D. | 同温、同压下,相同体积的一氧化碳和二氧化碳的质量比为7:11 |
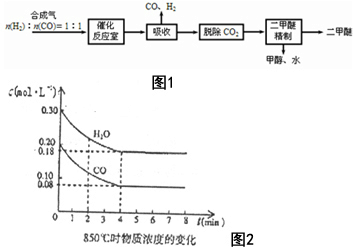 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1: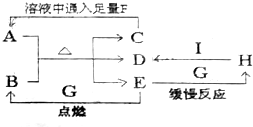 已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1:1混合加热,有如下转化关系:
已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1:1混合加热,有如下转化关系: