题目内容
15.氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、纺织印染、颜料、医药、电镀、有机合成等行业.以工业海绵铜为原料,采用硝酸铵氧化分解技术生产硫酸铜进而生产氯化亚铜.海绵铜的主要成分是CuO和Cu,生产工艺流程图如下.
思考并回答下列问题.
(1)生产原理:
①溶解时生成的还原产物在酸性溶液中稳定存在,请写出此时的氧化还原反应离子方程式:4Cu+10H++NO3-=4Cu2++NH4++3H2O.
②还原氯化:2CuSO4+(NH4)2SO3+2NH4Cl+H2O═2CuCl↓+2(NH4)2SO4+H2SO4
(2)得到副产品的化学式为(NH4)2SO4;
(3)生产后阶段,从滤液获得副产品的步骤:①蒸发浓缩②冷却结晶③过滤④洗涤 ⑤干燥.
(4)产品的洗涤方法是,先用pH=2的稀H2SO4洗,后用95%的酒精洗.酒精洗的目的是酒精易挥发,快速得到干燥CuCl产品,防止被氧化;请设计简单实验方案,检验稀H2SO4洗时是否洗干净:取最后一次洗涤液于试管中,加入氢氧化钠固体并加热,产生使湿润的红色石蕊试纸变蓝色的气体,则样品未洗涤干净,否则洗涤干净.
(5)定量分析:
称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol•L-1FeCl3溶液中,加水稀释至200mL得到溶液,取20.00mL 用0.1000mol•L-1的Ce(SO4)2溶液滴定到终点,消耗20.00mLCe(SO4)2.
①此实验涉及溶液配制与定量滴定的基本操作中,合理的是BC;
②有关反应式:Fe3++CuCl═Fe2++Cu2++Cl- Ce4++Fe2+═Fe3++Ce3+
则样品中CuCl的质量分数99.50%.
分析 海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸;
(1)溶解时生成的还原产物在酸性溶液中稳定存在,铜在硝酸铵和硫酸溶液中被硝酸氧化生成铜离子,硝酸根离子被还原为铵根离子;
(2)上述分析可知滤液主要是硫酸铵和硫酸,得到副产品为硫酸铵;
(3)从硫酸铵溶液中获得硫酸铵晶体,可以经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤;
(4)得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,酒精易挥发,用酒精洗涤CuCl产品,可快速除去固体表面的水分,防止水解、氧化,检验稀H2SO4洗时是否能洗干净,是取最后一次洗涤液检验是否含有硫酸铵,检验铵根的存在设计实验检验;
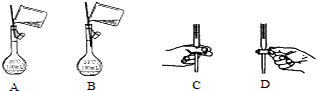
(5)溶液配制时,向容量瓶中转称溶液时,溶液不能沾到容量瓶刻度线上面,在打开酸式滴定管活塞时,要把活塞放在手心的位置,手指从另一侧打开活塞,由两个方程式可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000mol•L-1×0.02L=0.002mol,则2.000g样品中含有n(CuCl)=10×0.002mol=0.02mol,求出质量代入质量分数公式计算.
解答 解:(1)铜在硝酸铵和硫酸溶液中被硝酸氧化生成铜离子,硝酸钡还原为铵根离子,此时的氧化还原反应离子方程为4Cu+10H++NO3-=4Cu2++NH4++3H2O,
故答案为:4Cu+10H++NO3-=4Cu2++NH4++3H2O;
(2)上述分析可知滤液主要是硫酸铵和硫酸,得到副产品为硫酸铵,故答案为:(NH4)2SO4;
(3)从硫酸铵溶液中获得硫酸铵晶体,可以经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,故答案为:过滤;
(4)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,产品的洗涤方法是先用pH=2的稀H2SO4洗,后用95%的酒精洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,检验稀H2SO4洗时是否能洗干净,可以取最后一次洗涤液于试管中,加入氢氧化钠固体并加热,产生使湿润的红色石蕊试纸变蓝色的气体,则样品未洗涤干净,否则洗涤干净;
故答案为:酒精易挥发,快速得到干燥CuCl产品,防止被氧化;取最后一次洗涤液于试管中,加入氢氧化钠固体并加热,产生使湿润的红色石蕊试纸变蓝色的气体,则样品未洗涤干净,否则洗涤干净;
(5)①溶液配制时,向容量瓶中转称溶液时,溶液不能沾到容量瓶刻度线上面,在打开酸式滴定管活塞时,要把活塞放在手心的位置,手指从另一侧打开活塞,
故选BC;
②Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+可得到Ce4+~Fe2+~CuCl,n(Ce4+)=0.1000mol•L-1×0.02L=0.002mol,则2.000g样品中含有n(CuCl)=10×0.002mol=0.02mol,质量m(CuCl)=0.02mol×99.5g/mol=1.99g,因此样品中CuCl的质量分数=$\frac{1.99g}{2.000g}$×100%=99.50%,
故答案为:99.50%.
点评 本题考查了铜及其化合物性质的理解应用,主要是物质性质和反应产物的判断,掌握基础是关键,题目难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X元素形成的单质不一定是原子晶体 |
| A. | 将饱和氯水滴到淀粉碘化钾试纸上,如果试纸先变蓝后变白,说明氯气具有氧化性和漂白性 | |
| B. | 向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+═SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 | |
| C. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| D. | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的溶液,恢复红色,说明亚硫酸不稳定 |
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大 |
| A. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| B. | 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4-二甲基戊烷或3,3-二甲基戊烷 | |
| C. | 完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等 | |
| D. | 还原性染料靛蓝的结构简式为: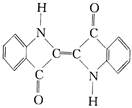 ,它的分子式是:C16H10N2O2 ,它的分子式是:C16H10N2O2 |
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )| A. | 原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32- | |
| B. | 反应最后形成的溶液中的溶质只有NaCl | |
| C. | 原溶液中一定含有Na2SO4 和NaOH | |
| D. | 原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |

| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用蒸馏水吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发结晶、冷却、过滤、洗涤 |
| A. | K+、NO3ˉ、HCO3ˉ、Clˉ | B. | SO42-、Mg2+、Clˉ、Na+ | ||
| C. | SO42-、Na+、Mg2+、CH3COOˉ | D. | Clˉ、AlO2ˉ、K+、NH4+ |