题目内容
13.下列三组物质中,均有一种物质的类别与其他三种不同.①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):ACO2;BH2O;CNa2CO3;
(2)这三种物质相互作用可生成一种新物质NaHCO3,写出该物质与足量澄清石灰水反应的离子方程式HCO3-+Ca2++OH-═H2O+CaCO3↓;
(3)在反应:K2Cr2O7+14HCl(浓)═2KCl+2CrCl3+3Cl2↑+7H2O中,K2Cr2O7是氧化剂,Cl2是氧化产物.
分析 (1)①物质类别为氧化物中的金属氧化物和非金属氧化物;
②物质类别为酸,氧化物;
③物质类别为碱和盐;
(2)碳酸氢钠和足量氢氧化钙反应,碳酸氢钠全部反应,依据碳酸氢根离子前的系数为1来书写离子方程式;
(3)元素化合价升高的物质失电子做还原剂,还原剂被氧化得到氧化产物,元素化合价降低的物质得到电子做氧化剂,氧化剂被还原得到还原产物.
解答 解:(1)①MgO、Na2O、CO2、CuO,物质都是氧化物,在氧化物中MgO、Na2O、CuO为金属氧化物,CO2为非金属氧化物,
②HCl、H2SO4、HNO3 水溶液中电离出的阳离子全部是氢离子的化合物都是酸,H2O是氧化物显中性,
③NaOH、KOH、Cu(OH)2 水溶液中电离出的阴离子全部是氢氧根离子的化合物都是碱,Na2CO3是金属离子和酸根离子构成的为盐,
均有一种物质的类别与其他三种不同,分别为:CO2 H2O Na2CO3 ,
故答案为:CO2;H2O;Na2CO3 ;
(2)碳酸氢钠和足量氢氧化钙反应,碳酸氢钠全部反应,依据碳酸氢根离子前的系数为1来书写,反应的离子方程式为:HCO3-+Ca2++OH-═H2O+CaCO3↓,
故答案为:HCO3-+Ca2++OH-═H2O+CaCO3↓;
(3)在反应:K2Cr2O7+14HCl(浓)═2KCl+2CrCl3+3Cl2↑+7H2O中,铬元素化合价+6价变化为+3价,元素化合价降低得到电子,K2Cr2O7做氧化剂被还原得到还原产物CrCl3,氯元素化合价-1价变化为0价,元素化合价升高失电子,HCl做还原剂被氧化得到氧化产物为Cl2,
故答案为:K2Cr2O7 ;Cl2.
点评 本题考查了物质分类,氧化还原反应,透彻理解有关概念,明确概念间的相互关系是解题的关键,题目难度不大.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 阴离子的半径:Z>Y | |
| B. | 气态氢化物稳定性:Z>Y>X | |
| C. | 氧化物的水化物的酸性:Z>Y | |
| D. | 元素W、X、Z各自最高和最低化合价的代数和分别为0、2、6 |
| A. | 无法计算 | B. | 77.8% | C. | 84.1% | D. | 81.4% |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 浓硫酸稀释时,应将水沿器壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌 | |
| B. | 浓硫酸不分解,不挥发,所以可以敞口放置于空气中 | |
| C. | 浓硫酸具有氧化性,稀硫酸无氧化性 | |
| D. | 可以用铁罐或铝槽车来运输冷的浓硫酸 |
| A. | 1:10 | B. | 1:5 | C. | 1:20 | D. | 1:10 |
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X元素形成的单质不一定是原子晶体 |
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大 |
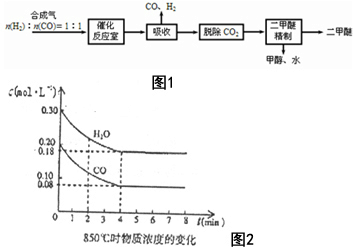 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1: