题目内容
下列离子方程式书写正确的是( )
| A、NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-═NH3↑+H2O |
| B、过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO |
| C、向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.漏掉碳酸氢根离子与氢氧根离子的反应;
B.过量CO2通入Ca(ClO)2溶液中,反应生成碳酸氢钙和次氯酸;
C.醋酸为弱电解质,应保留化学式;
D.向Ba(OH)2溶液中加入少量NaHSO3溶液,反应生成亚硫酸钡和氢氧化钠、水.
B.过量CO2通入Ca(ClO)2溶液中,反应生成碳酸氢钙和次氯酸;
C.醋酸为弱电解质,应保留化学式;
D.向Ba(OH)2溶液中加入少量NaHSO3溶液,反应生成亚硫酸钡和氢氧化钠、水.
解答:
解:A.NH4HCO3溶液与过量NaOH溶液反应,离子方程式:NH4++HCO3-+2OH-═NH3?H2O+H2O+CO32-,故A错误;
B.过量CO2通入Ca(ClO)2溶液中,离子方程式:ClO-+CO2+H2O═HCO3-+HClO,故B正确;
C.向Na2CO3溶液中加入过量CH3COOH溶液,离子方程式:CO32-+2CH3COOH═CO2↑+H2O+CH3COO-,故C错误;
D.向Ba(OH)2溶液中加入少量NaHSO3溶液,离子方程式:HSO3-+Ba2++OH-═BaSO3↓+H2O,故D错误;
故选:B.
B.过量CO2通入Ca(ClO)2溶液中,离子方程式:ClO-+CO2+H2O═HCO3-+HClO,故B正确;
C.向Na2CO3溶液中加入过量CH3COOH溶液,离子方程式:CO32-+2CH3COOH═CO2↑+H2O+CH3COO-,故C错误;
D.向Ba(OH)2溶液中加入少量NaHSO3溶液,离子方程式:HSO3-+Ba2++OH-═BaSO3↓+H2O,故D错误;
故选:B.
点评:离子方程式为高考重点,书写时应注意化学式的拆分、反应物用量对反应的影响,BD为易错选项.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图是我国“长征二号F”运载火箭发射现场.图中可以看到从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是( )
如图是我国“长征二号F”运载火箭发射现场.图中可以看到从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是( )| A、是溴蒸气,火箭发射时作氧化剂 |
| B、是二氧化氮气体,火箭发射时作还原剂 |
| C、是溴蒸气,火箭发射时作还原剂 |
| D、是二氧化氮气体,火箭发射时作氧化剂 |
下列物质间发生化学反应时,在不同情况下生成物不同的是( )
①C与O2 ②Na与O2 ③Na2CO3和HCl ④AgNO3和NH3?H2O ⑤Al2(SO4)2和Ba(OH)2 ⑥Cu和HNO3.
①C与O2 ②Na与O2 ③Na2CO3和HCl ④AgNO3和NH3?H2O ⑤Al2(SO4)2和Ba(OH)2 ⑥Cu和HNO3.
| A、仅①④ | B、仅①②④ |
| C、除⑤外 | D、全部 |
某NaCl和CaCl2的混合溶液中,c(Ca2+)=0.2mol?L-1,c(Cl-)=0.7mol?L-1,那么c(Na+)为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
下列关于物质的量的叙述中,正确的是( )
| A、物质的量就是物质的数量 |
| B、1mol任何物质都含有6.02×1023个原子 |
| C、1mol水中含有1mol氢分子和1mol氧原子 |
| D、1mol H2分子中含有2mol H |
下列说法中正确的是( )
| A、含有不同种元素的纯净物叫做化合物 |
| B、水溶液中能电离出H+的化合物一定是酸 |
| C、盐中一定含有金属元素 |
| D、含有氧元素的化合物一定是氧化物 |
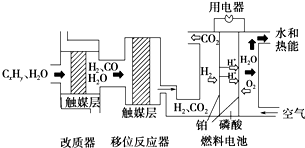 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A、该系统中只存在化学能和电能的相互转化 | ||
B、在移位反应器中,反应CO(g)+H2O(g)
| ||
| C、改质器和移位反应器的作用是将CxHy转化为H2和CO2 | ||
| D、该电池正极的电极反应为O2+4H++4e-=2H2O |