题目内容
13.KI在经酸化的溶液中被空气氧化生成I2.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.实验小组拟用0.8mol•L-1 KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 40 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(1)写出该反应的离子方程式4H++4I-+O2=2I2+2H2O;
(2)为确保A组实验在40℃下进行,实验操作是将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案,填写空格.以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值设计酸体积<10mL时,t预测值要小于同温对比值,设计酸体积>10mL时,t预测值要大于同温对比值,并写出与你预测相对应的探究实验的结论其他条件不变时,酸度越大反应速率越快.
分析 (1)KI在经酸化的溶液中被空气氧化生成I2,根据得失电子守恒、电荷守恒配平离子方程式;
(2)确保A组实验在40℃下进行,可以采用水浴加热的方法;
(3)根据“淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色”进行判断;
(4)根据ABC探究的是温度对反应速率的影响可知,D应该为探究酸度对反应速率的影响,据此完成本题;
(5)酸溶液浓度越大,反应速率越快,需要的时间越少,据此设计实验并写出结论.
解答 解:(1)KI在经酸化的溶液中被空气氧化生成I2,氧气化合价降低4价,碘离子化合价升高1价,则氧气与碘离子的计量数之比为1:4,根据电荷守恒配平离子方程式为:4H++4I-+O2=2I2+2H2O,
故答案为:4H++4I-+O2=2I2+2H2O;
(2)为确保A组实验在40℃下进行,应采用的控温操作方法为:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度,
故答案为:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度;
(3)淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色,所以B组实验中“没出现蓝色”,可能是温度(TB)高于75℃,淀粉与碘不显色,
故答案为:温度(TB)高于75℃,淀粉与碘不显色;
(4)A-C三组实验探究了温度对反应速率的影响,实验的目的是探究温度和酸度对反应速率的影响,则D的目的是探究酸度对反应速率的影响,所以温度可以为40℃或5℃,硫酸体积可以为15mL,水、碘化钾溶液的体积为5mL,淀粉溶液为1mL,
故答案为:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 40或5 | 15 | 5 | 5 | 1 | t |
(5)当酸溶液体积小于10mL时,反应速率减小,当水溶液体积减小时,反应速率加快,即:酸体积<10mL时,t预测值要小于同温对比值;若酸体积>10mL时,t预测值要大于同温对比值,据此可以得出结论为:酸度越大反应速率越快,
故答案为:设计酸体积<10mL时,t预测值要小于同温对比值,设计酸体积>10mL时,t预测值要大于同温对比值;其他条件不变时,酸度越大反应速率越快.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,注意掌握探究影响化学反应速率的因素,明确对照试验的设计原则,试题有利于培养学生的分析能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
(1)判断混合物中Cl-是否一定存在否.(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度:c(SO42-)=0.1mol/L、c(CO32-)=0.2mol/L、c(NH4+)=0.4mol/L、c(K+)≥0.2mol/L.

| A. | 该同学的实验目的是分离氯化钠、氯化钙 | |
| B. | 上图括号内的操作步骤均为加热蒸发 | |
| C. | 按此实验方案可得到较纯净的NaCl固体 | |
| D. | 按此实验方案可得到较纯净的CaCl2固体 |
| A. | v(SO2)=4mol•L-1•min-1 | B. | v(O2)=3mol•L-1•min-1 | ||
| C. | v(SO2)=0.1mol•L-1•s-1 | D. | v(O2)=0.1mol•L-1•s-1 |
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫做该物质的热值 | |
| B. | 把FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| C. | 用25mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 太阳能电池是把太阳能转化为内能的装置 |
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.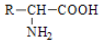 .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
. .
.