题目内容
14.分析下列氧化还原反应中化合价的变化,指出氧化剂和还原剂(1)2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3 氧化剂Cl2 还原剂2Fe
(2)CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2氧化剂CuO 还原剂CO
(3)2Al+3H2SO4=Al2(SO4)3+3H2↑ 氧化剂H2SO4 还原剂Al
(4)2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ 氧化剂KClO3 还原剂KClO3.
分析 化合价升高时元素失去电子,化合价降低时元素得到电子,氧化还原反应中得失电子守恒,得电子的物质是氧化剂,失电子的物质是还原剂.
解答 解:(1)该反应2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3中,铁失电子化合价升高,氯气得电子化合价降低,所以铁是还原剂,氯气是氧化剂,故答案为:Cl2,Fe;
(2)CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2中,氧化铜中铜的化合价降低,是氧化剂,一氧化碳中碳的化合价升高是还原剂,故答案为:CuO;CO;
(3)2Al+3H2SO4=Al2(SO4)3+3H2↑ 中铝的化合价升高是还原剂,而硫酸中氢离子的化合价降低是氧化剂,故答案为:H2SO4;Al;
(4)2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ 中氯酸钾中氯元素的化合价降低,氧元素的化合价升高,所以氯酸钾既是氧化剂也是还原剂,故答案为:KClO3;KClO3.
点评 本题考查氧化还原反应中电子的转移、氧化剂和还原剂的判断,明确化合价升高的元素失去电子及电子守恒是解答本题的关键,难度不大.

练习册系列答案
相关题目
5.在不同条件下分别测得反应2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)的化学反应速率,其中表示该反应进行的最快的是( )
| A. | v(SO2)=4mol•L-1•min-1 | B. | v(O2)=3mol•L-1•min-1 | ||
| C. | v(SO2)=0.1mol•L-1•s-1 | D. | v(O2)=0.1mol•L-1•s-1 |
2.将5mL 10mol/L的硫酸稀释到100mL,所得硫酸溶液的物质的量浓度是( )
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
9.按要求回答下列问题:
(1)填写表空格中,物质类别所对应的官能团名称或结构简式
(2)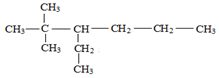 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.
(3)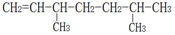 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.
(4)2,4,6-三硝基甲苯(TNT)的结构简式为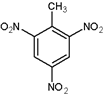 .
.
(1)填写表空格中,物质类别所对应的官能团名称或结构简式
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.(3)
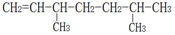 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.(4)2,4,6-三硝基甲苯(TNT)的结构简式为
 .
.
19.关于化学对社会进步和人类文明的贡献,下列说法不正确的是( )
| A. | 化石燃料的直接利用,促进了低碳经济的发展 | |
| B. | 新材料的研制和应用,提高了人们的生活品质 | |
| C. | 合成药物的研发和使用,促进了医疗卫生事业的发展 | |
| D. | 化肥的合理使用提高了农作物产量,缓解了人类粮食危机 |
3.下列表述中合理的是( )
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫做该物质的热值 | |
| B. | 把FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| C. | 用25mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 太阳能电池是把太阳能转化为内能的装置 |
4.第四周期过渡元素常与H2O、NH3、CN-等形成配合物.
(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,写出该配合物的化学式K4[Fe(CN)6].
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为do或d10排布时,无颜色;为d1一d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).[Mn(H2O)6]2+配离子中存在的化学键有CD (填标号)
A.金属键 B.离子键 C.共价键 D.配位键
(3)H2S和H2O2的主要物理性质比较如表:
①H2O2分子中O原子采取sp3杂化,写出H2O2的电子式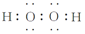
②H2S和H2O2的相对分子质量相同,造成沸点差异的主要原因是H2O2分子间形成氢键;造成溶解度差异的主要原因是H2O2分子与H2O分子间形成氢键.
(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,写出该配合物的化学式K4[Fe(CN)6].
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为do或d10排布时,无颜色;为d1一d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).[Mn(H2O)6]2+配离子中存在的化学键有CD (填标号)
A.金属键 B.离子键 C.共价键 D.配位键
(3)H2S和H2O2的主要物理性质比较如表:
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
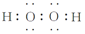
②H2S和H2O2的相对分子质量相同,造成沸点差异的主要原因是H2O2分子间形成氢键;造成溶解度差异的主要原因是H2O2分子与H2O分子间形成氢键.