题目内容
13.以二氧化锰为原料制取高锰酸钾晶体的实验流程如图: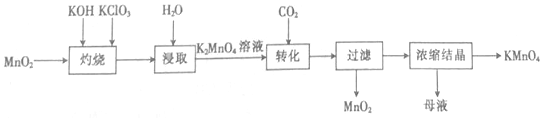
下列有关说法正确的是( )
| A. | “灼烧”时,可在玻璃坩埚中进行 | |
| B. | “浸取”时,可用无水乙醇代替水 | |
| C. | “转化”反应中,氧化产物与还原产物的物质的量之比为2:1 | |
| D. | “浓缩结晶”后的母液中只有KMnO4和K2CO3两种溶质 |
分析 由流程可知,灼烧在铁坩埚中进行,结合浸取后生成K2MnO4,可知Mn元素的化合价升高,则氯酸钾中Cl元素的化合价降低,转化中CO2与K2MnO4发生3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3,过滤分离出MnO2,对滤液浓缩结晶得到KMnO4,以此来解答.
解答 解:A.“灼烧”时,可在铁坩埚中进行,KOH与玻璃中的二氧化硅反应,故A错误;
B.“浸取”时,不能用无水乙醇代替水,因K2MnO4不易溶于乙醇,故B错误;
C.由3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3,氧化产物为KMnO4,还原产物为MnO2,氧化产物与还原产物的物质的量之比为2:1,故C正确;
D.“浓缩结晶”后的母液中有K2MnO4、KMnO4和K2CO3等溶质,若二氧化碳过量还可能存在碳酸氢钾,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.某原电池装置如图所示,下列有关说法不正确的是( )
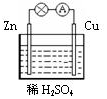

| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
11.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点.甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)?CH3NH2(g)+H2O(g)△H.已知该反应中相关化学键的键能数据如下:
则该反应的△H=-12kJ•mol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)?CH3OH(g)△H<0.在一定条件下,将l mol CO和2mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
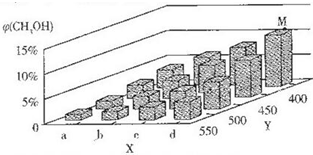
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为25%.
②X轴上a点的数值比b点小(填“大”或“小”).某同学认为上图中Y轴表示温度,你认为他判断的理由是随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度.
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3mol PbI2的反应中,转移电子的物质的量为2mol
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,则Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=4000
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)?2HI(g) 的△H小于(填大于或小于)0.
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O?3H++HSO4+2I-,I2+I-?I3-,
图2中曲线a、b分别代表的微粒是H+、I3-(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比.
(1)制取甲胺的反应为CH3OH(g)+NH3(g)?CH3NH2(g)+H2O(g)△H.已知该反应中相关化学键的键能数据如下:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)?CH3OH(g)△H<0.在一定条件下,将l mol CO和2mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为25%.
②X轴上a点的数值比b点小(填“大”或“小”).某同学认为上图中Y轴表示温度,你认为他判断的理由是随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度.
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3mol PbI2的反应中,转移电子的物质的量为2mol
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,则Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=4000
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)?2HI(g) 的△H小于(填大于或小于)0.
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O?3H++HSO4+2I-,I2+I-?I3-,
图2中曲线a、b分别代表的微粒是H+、I3-(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比.
12.某小组设计如图所示装置,下列说法正确的是( )


| A. | 闭合K1,断开K2,可防止Fe发生吸氧腐蚀 | |
| B. | 闭合K1,断开K2,Cl-向石墨电极移动 | |
| C. | 闭合K2,断开K1,可用于制备家用消毒液(主要成分NaClO) | |
| D. | 闭合K2,断开K1,电解质溶液中Na+的浓度不变 |


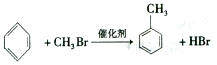 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种. .
. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +
+
 .
.
