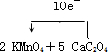题目内容
3.某温度时,在2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.(1)反应物为X、Y,生成物为Z.
(2)由图中所给数据进行分析,该反应的化学方程式为3X+Y?2Z.
(3)反应从开始至2min末,用Z的浓度变化表示的平均反应速率为v(Z)=0.05mol/(L.min)
(4)当反应进行到3min末,该反应是(填“是”或“否”)达到化学平衡状态.

分析 (1)根据图知,随着反应的进行,物质的量减小的为反应物、物质的量增大的为生成物;
(2)反应达到平衡状态时,△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比;
(3)v(Z)=$\frac{\frac{△n}{V}}{△t}$;
(4)可逆反应达到平衡状态时,各物质的物质的量不变.
解答 解:(1)随着反应的进行,物质的量减小的为反应物、物质的量增大的为生成物,根据图知,X、Y是反应物而Z是生成物,故答案为:X、Y;Z;
(2)反应达到平衡状态时,△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,反应方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)v(Z)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L.min),故答案为:0.05mol/(L.min);
(4)可逆反应达到平衡状态时,各物质的物质的量不变,根据图知,反应达到2min时为平衡状态,在3min时也是平衡状态,故答案为:是.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析判断及计算能力,明确化学反应计量数之比与物质的量变化量之比关系是解本题关键,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目
11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
18.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 7.80 g Na2O2与5.85 g NaCl所含阴离子数相等 | |
| D. | 常温常压下,18g H2O含有的氢原子数为3NA |
13.以二氧化锰为原料制取高锰酸钾晶体的实验流程如图: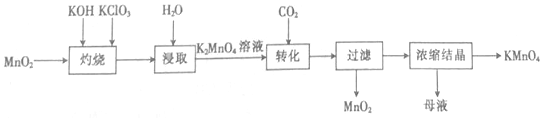
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | “灼烧”时,可在玻璃坩埚中进行 | |
| B. | “浸取”时,可用无水乙醇代替水 | |
| C. | “转化”反应中,氧化产物与还原产物的物质的量之比为2:1 | |
| D. | “浓缩结晶”后的母液中只有KMnO4和K2CO3两种溶质 |
 如图是一个电化学过程的示意图,请按要求回答下列问题
如图是一个电化学过程的示意图,请按要求回答下列问题