题目内容
11.随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点.甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:(1)制取甲胺的反应为CH3OH(g)+NH3(g)?CH3NH2(g)+H2O(g)△H.已知该反应中相关化学键的键能数据如下:
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
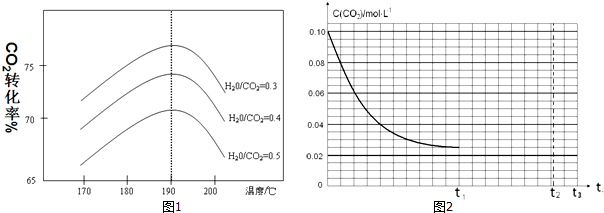
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)?CH3OH(g)△H<0.在一定条件下,将l mol CO和2mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为25%.
②X轴上a点的数值比b点小(填“大”或“小”).某同学认为上图中Y轴表示温度,你认为他判断的理由是随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度.
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3mol PbI2的反应中,转移电子的物质的量为2mol
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,则Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=4000
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)?2HI(g) 的△H小于(填大于或小于)0.
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O?3H++HSO4+2I-,I2+I-?I3-,
图2中曲线a、b分别代表的微粒是H+、I3-(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比.
分析 (1)反应热=反应物总键能-生成物总键能;
(2)①根据三行式计算得到;
②根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,结合平衡移动原理回答;
(3)由四氧化三铅和氢碘酸反应制备难溶的PbI2,反应的化学方程式为:Pb3O4+8HI=3PbI2+I2+4H2O,铅已达最高价态,有较强氧化性,氢碘酸还原性较强,易被四氧化三铅氧化为碘.,结合电子守恒计算;
(4)PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,沉淀溶解平衡PbI2(s)?Pb2+(aq)+2I-(aq),c(Pb2+)=1.0×10-3 mol•L-1,c(I-)=2.0×10-3mol/L,则Ksp(PbI2)=c(Pb2+)c2(I-);反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{{c}^{2}({I}^{-})}$=$\frac{{c}^{2}(C{l}^{-})}{{c}^{2}({I}^{-})}$×$\frac{c(P{b}^{2+})}{c(P{b}^{2+})}$=$\frac{Ksp(PbC{l}_{2})}{Ksp(Pb{I}_{2})}$;
(5)①图象中分析可知随的升高,HI减小,H2增大,反应H2(g)+I2(g)?2HI(g) 说明升温平衡逆向进行;
②根据图象b为从零越来越大的离子,a为不变的离子,结合反应过程分析判断;减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比提高碘的还原率;
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H=
(2)①设CO的转化量是x,则
CO(g)+2H2(g)?CH3OH(g);
初始量:1mol 2mol 0
变化量:x 2x x
平衡量:1-x 2-2x x
平衡时,CH3OH的体积分数为10%,则$\frac{x}{1-x+2-2x+x}$×100%=10%,
x=0.25,
所以CO的转化率为$\frac{0.25mol}{1mol}$×100%=25%,
故答案为:25%;
②根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度,
故答案为:小;随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度;
(3)由四氧化三铅和氢碘酸反应制备难溶的PbI2,反应的化学方程式为:Pb3O4+8HI=3PbI2+I2+4H2O,HI做还原剂,碘元素化合价-1价变化为I2,每生成3mol PbI2的反应中电子转移2mol,
故答案为:2mol;
(4)PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol•L-1,沉淀溶解平衡PbI2(s)?Pb2+(aq)+2I-(aq),c(Pb2+)=1.0×10-3 mol•L-1,c(I-)=2.0×10-3mol/L,则Ksp(PbI2)=c(Pb2+)c2(I-)=1.0×10-3 mol•L-1×(2.0×10-3mol/L)2=4×10-9;反应PbCl2(s)+2I-(aq)?PbI2(s)+2Cl-(aq)的平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{{c}^{2}({I}^{-})}$=$\frac{{c}^{2}(C{l}^{-})}{{c}^{2}({I}^{-})}$×$\frac{c(P{b}^{2+})}{c(P{b}^{2+})}$=$\frac{Ksp(PbC{l}_{2})}{Ksp(Pb{I}_{2})}$=$\frac{1.6×1{0}^{-5}}{4×1{0}^{-9}}$=4000,
故答案为:4×10-9;4000;
(5)①图象中分析可知随的升高,HI减小,H2增大,反应H2(g)+I2(g)?2HI(g) 说明升温平衡逆向进行,正反应为放热反应,△H<0,
故答案为:小于;
②由图象b为从零越来越大的离子,则根据SO2+I2+2H2O=3H++HSO4-+2I-,I-+I2?I3-,反应中越来越多的离子为I3-,反应过程中氢离子始终不变,由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比,
故答案为:H+、I3-; 减小$\frac{n({I}_{2})}{n(S{O}_{2})}$的投料比.
点评 本题考查了反应能量变化和键能的计算关系,化学平衡三行计算和平衡转化率的计算,沉淀溶解平衡的理解应用、图象变化特征和氧化还原反应原理等知识点,掌握基础是解题关键,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案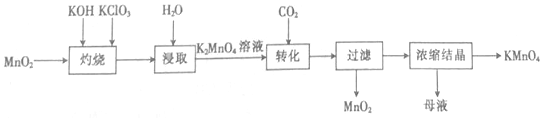
下列有关说法正确的是( )
| A. | “灼烧”时,可在玻璃坩埚中进行 | |
| B. | “浸取”时,可用无水乙醇代替水 | |
| C. | “转化”反应中,氧化产物与还原产物的物质的量之比为2:1 | |
| D. | “浓缩结晶”后的母液中只有KMnO4和K2CO3两种溶质 |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①③的化学方程式及此实验的结论)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
此实验的结论:从左到右,同周期元素原子的失电子能力递减,得电子能力递增.
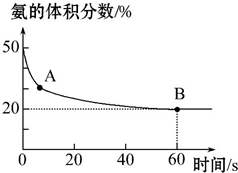 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).
某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体).
A点的正反应速率v正(CO2)大于(填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).
实验测得在不同温度下的平衡数据如下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
②下列说法能说明上述反应建立化学平衡状态的是CD.
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化
D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=$\frac{1}{(3.2×1{0}^{-3})^{2}×(1.6×1{0}^{-3})}$(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的2倍.
④温度一定时,向上述容器中再按照NH3和CO2物质的量之比为2:1充入一定量的混合气体,平衡向右(填“向左”“向右”或“不”)移动,该平衡中NH3的浓度与原平衡时NH3浓度相比前者大(填“前者大”“后者大”或“相等”).
| A. | 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液 | |
| C. | c(HCO3-)=0.05mol/L | |
| D. | 4.88g沉淀中含有3种成分 |
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| D. | 硅胶作袋装食品的干燥剂时发生了化学变化 |