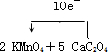题目内容
1.含铬污水处理是污染治理的重要课题.污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:
(1)加酸可以使CrO42-转化为Cr2O72-:2CrO42-+2H+?Cr2O72-+H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=1.0×105.
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O.而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降低到10-5mol•L-1,溶液的pH应升高到5.
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的正极.
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液.Cr(OH)3溶于稀硫酸的化学方程式为2Cr(OH)3+3H2SO4=2Cr2(SO4)3+3H2O.往100.00mL 0.1000mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液,请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图

分析 (1)根据化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}){c}^{2}({H}^{+})}$进行计算;
(2)根据二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原生成硫酸根和三价铬离子;根据Ksp[Cr(OH)3]=10-32计算c(OH-),从而计算PH;
(3)Fe作阳极失电子生成亚铁离子,提供还原剂;
(4)Cr(OH)3溶于稀硫酸生成硫酸铬和水,根据反应的量画出生成沉淀的物质的量与加入NaOH溶液体积的关系图.
解答 解:(1)若常温下pH=1溶液中Cr2O72-浓度为0.1mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍即CrO42-浓度为0.01mol•L-1,化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}){c}^{2}({H}^{+})}$=$\frac{0.1}{0.0{1}^{2}×0.{1}^{2}}$=1.0×105,
故答案为:1.0×105;
(2)因为二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原生成硫酸根和三价铬离子,所以离子方程式为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;因为Ksp[Cr(OH)3]=10-32,所以c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol•L-1,则PH=5,
故答案为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;5;
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+,Fe作阳极失电子生成亚铁离子,提供Fe2+作还原剂,所以Fe与正极相连;
故答案为:正;
(4)Cr(OH)3溶于稀硫酸生成硫酸铬和水,化学方程式为2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O,往100.00mL 0.1000mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液,根据反应Cr3++3OH-=Cr(OH)3,Cr(OH)3+OH-=CrO2-+2H2O,所以应该为三份沉淀,一份溶解,生成沉淀的物质的量与加入NaOH溶液体积的关系图为 ,
,
故答案为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O; .
.
点评 本题考查了平衡常数的计算、氧化还原反应、溶度积常数的计算等知识点,题目难度中等,注意把握平衡常数和溶度积常数的表达式以及计算方法,侧重于考查学生的分析能力和计算能力.

| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
(1)该时间范围内的平均反应速率v(CO2)=0.006mol/(L•min)
(2)CO的转化率60%.
(3)欲提高CO的平衡转化率,可采取的措施是D.
A.减少Fe的量 B.增加Fe2O3的量
C.升高反应温度 D.移出部分CO2
E.使用合适的催化剂 F.减少容器的容积
Ⅱ.已知化学反应:
①Fe(s)+CO2(g)?FeO(s)+CO(g),平衡常数为K1
②Fe(s)+H2O(g)?FeO(s)+H2(g),平衡常数为K2.
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(5)现有反应③:该反应的平衡常数的数学表达式K3=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.
(6)根据反应①和②可以推导出K1、K2与K3之间的关系式,K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式和上表数据,也能推断出反应③的△H>0(填“>”“<”).
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)下列说法不正确的是AD(填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,pH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
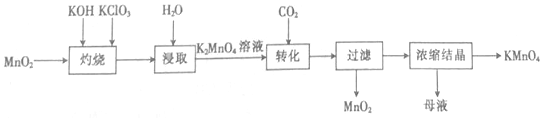
下列有关说法正确的是( )
| A. | “灼烧”时,可在玻璃坩埚中进行 | |
| B. | “浸取”时,可用无水乙醇代替水 | |
| C. | “转化”反应中,氧化产物与还原产物的物质的量之比为2:1 | |
| D. | “浓缩结晶”后的母液中只有KMnO4和K2CO3两种溶质 |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
(1)实验目的:研究同周期元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①③的化学方程式及此实验的结论)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
此实验的结论:从左到右,同周期元素原子的失电子能力递减,得电子能力递增.
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| D. | 硅胶作袋装食品的干燥剂时发生了化学变化 |