题目内容
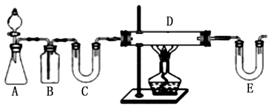
12.某小组设计如图所示装置,下列说法正确的是( )
| A. | 闭合K1,断开K2,可防止Fe发生吸氧腐蚀 | |
| B. | 闭合K1,断开K2,Cl-向石墨电极移动 | |
| C. | 闭合K2,断开K1,可用于制备家用消毒液(主要成分NaClO) | |
| D. | 闭合K2,断开K1,电解质溶液中Na+的浓度不变 |
分析 闭合K1,断开K2,铁、石墨、饱和食盐水构成原电池,铁在中性环境发生吸氧腐蚀,铁失电子作负极,阴离子向负极移动;闭合K2,断开K1,有外接电源,为电解池,铁与电源负极相连作阴极,溶液中的氢离子在阴极得电子发生还原反应产生氢气,水的电离受到破坏,氢氧根的浓度增大,在该区域生成氢氧化钠,石墨与电源正极相连作阳极,氯离子在阳极失电子发生氧化反应产生氯气,据此解答.
解答 解:闭合K1,断开K2,铁、石墨、饱和食盐水构成原电池,铁在中性环境发生吸氧腐蚀,铁失电子作负极,阴离子向负极移动;闭合K2,断开K1,有外接电源,为电解池,铁与电源负极相连作阴极,溶液中的氢离子在阴极得电子发生还原反应产生氢气,水的电离受到破坏,氢氧根的浓度增大,在该区域生成氢氧化钠,石墨与电源正极相连作阳极,氯离子在阳极失电子发生氧化反应产生氯气.
A.闭合K1,Fe作负极,在中性溶液中发生吸氧腐蚀,故A错误;
B.原电池装置中,阴离子向负极移动,故B错误;
C.闭合K2,形成电解池,阳极产生的氯气向上扩散与阴极产生的氢氧化钠反应生成次氯酸钠,故C正确;
D.电解消耗水,Na+的浓度增大,故D错误;
故选C.
点评 本题考查了原电池和电解池原理的应用,题目难度不大,注意把握吸氧腐蚀的条件、电极的判断和电极方程式的书写.

练习册系列答案
相关题目
13.以二氧化锰为原料制取高锰酸钾晶体的实验流程如图: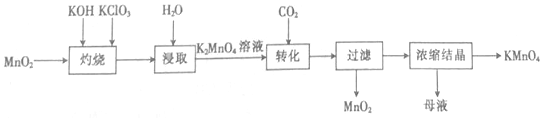
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | “灼烧”时,可在玻璃坩埚中进行 | |
| B. | “浸取”时,可用无水乙醇代替水 | |
| C. | “转化”反应中,氧化产物与还原产物的物质的量之比为2:1 | |
| D. | “浓缩结晶”后的母液中只有KMnO4和K2CO3两种溶质 |
3.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:取200mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g,向沉淀中加入过量的盐酸,有2.33g.关于原溶液组成的结论,不正确的是( )
| A. | 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液 | |
| C. | c(HCO3-)=0.05mol/L | |
| D. | 4.88g沉淀中含有3种成分 |
20.化学与生活密切相关,下列有关说法正确的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| D. | 硅胶作袋装食品的干燥剂时发生了化学变化 |
7.某溶液中含有SO32-、CO32-、HCO3-、SO42-、Na+,向该溶液中加入足量的Na2O2,假设溶液体积变化忽略不计,下列说法不正确的是( )
| A. | 有气体生成 | |
| B. | Na+浓度基本不变 | |
| C. | HCO3-浓度减小而CO32-浓度增大 | |
| D. | SO32-发生反应的离子方程式为:SO32-+Na2O2+H2O=2Na++SO42-+2OH- |
17.短周期元素X、Y、Z、W的原子序数依次增大.它们分别位于不同的主族,X 的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于10.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 沸点:XW2>Y2W | |
| C. | 最高价氧化物对应的水化物的酸性:X>Z | |
| D. | 简单氢化物的热稳定性:Z<W |
4.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于0.5 mol•L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42-+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |