题目内容
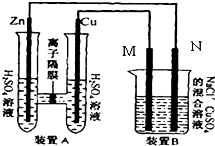 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加考点:原电池和电解池的工作原理
专题:
分析:A能自发的进行氧化还原反应而作原电池,B连接外接电源属于电解池;根据转移电子相等及溶液中铜离子的物质的量计算N上质量增加量;此时,A装置:铜棒电极方程式为2H++2e-=H2↑,B装置M作阳极,N作阴极,
阳极上氯离子放电生成氯气2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,根据电极反应式结合电子守恒来计算回答.
阳极上氯离子放电生成氯气2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,根据电极反应式结合电子守恒来计算回答.
解答:
解:A能自发的进行氧化还原反应而作原电池,B连接外接电源属于电解池,
M作阳极,N作阴极,电解氯化钠和硫酸铜混合溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,串联电路中转移电子数相等,所以当装置A中Zn棒质量减少6.5g时,
×64g/mol=6.4g,实际上溶液中铜离子的质量=0.1mol/L×0.5L×64g/mol=3.2g,所以析出铜的质量是3.2g,
当装置A中Zn棒质量减少6.5g时,装置中转移的电子数为:
×2=0.2mol,B中NaCl、CuSO4的物质的量都为n=cv=0.1mol/L×0.5L=0.05mol,
A装置原电池中,易失电子的金属锌作负极,铜作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为:2H++2e-=H2↑,生成的氢气的物质的量为0.1mol,
B装置中阳极上氯离子放电生成氯气2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,生成氯气0.025mol,根据得失电子守恒,生成氧气
=0.0375mol,阴极发生Cu2++2e-=Cu、生成铜0.05mol,根据得失电子守恒,2H++2e-=H2↑,
=0.05mol,
所以生成气体总的物质的量为:0.1mol+0.025mol+0.0375mol+0.05mol=0.2125mol,总体积为v=n×vm=0.2125mol×22.4L/mol=4.76L,
故答案为:3.2;4.76;
M作阳极,N作阴极,电解氯化钠和硫酸铜混合溶液时,阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,串联电路中转移电子数相等,所以当装置A中Zn棒质量减少6.5g时,
| 6.5g |
| 65g/mol |
当装置A中Zn棒质量减少6.5g时,装置中转移的电子数为:
| 6.5g |
| 65g/mol |
A装置原电池中,易失电子的金属锌作负极,铜作正极,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为:2H++2e-=H2↑,生成的氢气的物质的量为0.1mol,
B装置中阳极上氯离子放电生成氯气2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,生成氯气0.025mol,根据得失电子守恒,生成氧气
| 0.2mol-0.05mol |
| 4 |
| 0.2mol-0.05×2mol |
| 2 |
所以生成气体总的物质的量为:0.1mol+0.025mol+0.0375mol+0.05mol=0.2125mol,总体积为v=n×vm=0.2125mol×22.4L/mol=4.76L,
故答案为:3.2;4.76;
点评:本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出原电池池的正负级,进而判断出电解池的阴阳极,要注意串联电路,各电极上得失电子的数目相等,做题时要正确写出电极方程式,准确判断两极上离子的放电顺序,题目难度中等.

练习册系列答案
相关题目
下列物质属于纯净物的是( )
| A、福尔马林 | B、聚氯乙烯 |
| C、纤维素 | D、硬脂酸甘油酯 |
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2-、CO32- 现取三份20mL该溶液进行如下实验.根据上述实验,以下说法正确的是( )
①第一份加入足量稀盐酸,无任何气体产生;
②第二份加入足量NaOH,经搅拌,过滤,洗涤,灼烧,最后得到x g固体;
③第三份滴加0.1mol.L-1酸性KMnO4溶液,反应至终点,共消耗其体积为VmL;
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色.
①第一份加入足量稀盐酸,无任何气体产生;
②第二份加入足量NaOH,经搅拌,过滤,洗涤,灼烧,最后得到x g固体;
③第三份滴加0.1mol.L-1酸性KMnO4溶液,反应至终点,共消耗其体积为VmL;
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色.
| A、原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B、由实验①无法推断原混合溶液中是否含有SO42- |
| C、由实验①、②可判断原混合溶液中是否含有Fe3+ |
| D、由实验③可判断原混合溶液中存在Fe2+ |
下列有关说法正确的是 ( )
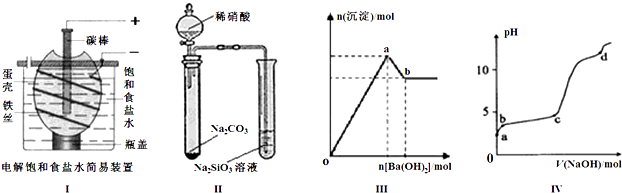

| A、按图Ⅰ装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B、按图Ⅱ装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
| C、图Ⅲ表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、图Ⅳ表示:室温时,将1mol?L-1 NaOH溶液逐滴滴入0.2mol?L-1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
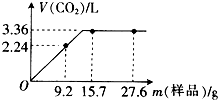 某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.
某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.