题目内容
计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离.回答下列关于多元弱酸HnX的问题.
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是 .
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因: .
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液中c(H+)约为 mol/L.(已知
≈20.6)
(4)已知KHC2O4溶液呈酸性.
①KHC2O4溶液中,各离子浓度由大到小的顺序是 .
②在KHC2O4溶液中,各粒子浓度关系正确的是 .
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因:
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液中c(H+)约为
| 425 |
(4)已知KHC2O4溶液呈酸性.
①KHC2O4溶液中,各离子浓度由大到小的顺序是
②在KHC2O4溶液中,各粒子浓度关系正确的是
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)若要使HnX溶液中c(H+)/c(HnX)增大,应是平衡向电离的方向移动,结合影响平衡移动的因素解答该题;
(2)根据多元弱酸的分别水解书写;
(3)根据草酸的电离主要由第一步电离决定计算;
(4)①根据草酸氢根离子的水解程度小于电离程度判断溶液中离子浓度大小;
②草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,比较HC2O4-的电离和水解程度可判断A;从溶液物料守恒和电核守恒的角度判断B;从溶液电中性的角度判断C;从溶液物料守恒来判断D.
(2)根据多元弱酸的分别水解书写;
(3)根据草酸的电离主要由第一步电离决定计算;
(4)①根据草酸氢根离子的水解程度小于电离程度判断溶液中离子浓度大小;
②草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,比较HC2O4-的电离和水解程度可判断A;从溶液物料守恒和电核守恒的角度判断B;从溶液电中性的角度判断C;从溶液物料守恒来判断D.
解答:
解:(1)A.弱电解质的电离为吸热过程,加热促进电离,则比值增大,故A正确;
B.加少量固态HnX,HnX浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故B错误;
C.加入烧碱溶液,反应生成弱酸根,c(H+)减小,促进HnX的电离,则比值减小,故C错误;
D.加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡:CH3COOH?CH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的大,所以比值增大,故D正确;
故选AD;
(2)NanX呈碱性是由于弱酸根水解引起的,方程式为Xn-+H2O?HX(n-1)-+OH-;故答案为:Xn-+H2O?HX(n-1)-+OH-;
(3)因为二元弱酸的电离主要由第一步决定,所以0.2mol/L H2C2O4溶液中c(H+)主要由第一步决定,设草酸第一步电离的氢离子浓度为xmol/L,则根据K1=
=
=5×10-2,解得x=0.078mol/L,故答案为:0.078mol/L;
(4)①草酸氢钾,由于草酸氢根离子的电离程度远远大于其水解程度,所以溶液显示酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
②A.草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故A错误;
B.KHC2O4溶液中,根据物料守恒可得:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),电荷守恒为:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),将钾离子浓度带入电荷守恒可得:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-),即c(H2C2O4)+c(H+)-c(C2O42-)=c(OH-),故B错误;
C.溶液遵循电中性原则,则有c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故C正确;
D.在0.1mol?L-1KHC2O4溶液中,存在H2C2O4、C2O42-、HC2O4-和K+,根据物料守恒可知c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确.
故选CD.
B.加少量固态HnX,HnX浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故B错误;
C.加入烧碱溶液,反应生成弱酸根,c(H+)减小,促进HnX的电离,则比值减小,故C错误;
D.加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡:CH3COOH?CH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的大,所以比值增大,故D正确;
故选AD;
(2)NanX呈碱性是由于弱酸根水解引起的,方程式为Xn-+H2O?HX(n-1)-+OH-;故答案为:Xn-+H2O?HX(n-1)-+OH-;
(3)因为二元弱酸的电离主要由第一步决定,所以0.2mol/L H2C2O4溶液中c(H+)主要由第一步决定,设草酸第一步电离的氢离子浓度为xmol/L,则根据K1=
| C(HC 2O 4 -)C(H +) |
| C(H 2C 2O 4) |
| x×x |
| 0.2-x |
(4)①草酸氢钾,由于草酸氢根离子的电离程度远远大于其水解程度,所以溶液显示酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
②A.草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故A错误;
B.KHC2O4溶液中,根据物料守恒可得:c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),电荷守恒为:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),将钾离子浓度带入电荷守恒可得:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-),即c(H2C2O4)+c(H+)-c(C2O42-)=c(OH-),故B错误;
C.溶液遵循电中性原则,则有c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故C正确;
D.在0.1mol?L-1KHC2O4溶液中,存在H2C2O4、C2O42-、HC2O4-和K+,根据物料守恒可知c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确.
故选CD.
点评:本题考查弱酸的电离及其计算,盐类水解的应用及其离子浓度的大小比较,题目难度中等,本题注意(4)草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,结合溶液中的守恒解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列与有机物的结构、性质相关的叙述错误的是( )
| A、分子式为C5H12的烃有三种可能的结构 |
| B、乙醇分子中含有羟基,可以和金属Na反应生成H2 |
| C、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中相似的碳碳双键 |
| D、淀粉、蛋白质、油脂、葡萄糖在一定条件下均能发生水解反应 |
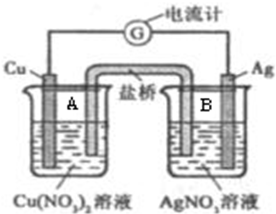 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:

 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.

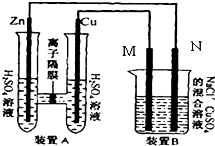 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加