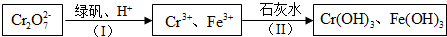题目内容
2.将少量饱和氯化铁溶液滴入沸水中,继续煮沸,可制得Fe(OH)3胶体,反应的方程式为:FeCl3+3H2O$\frac{\underline{\;煮沸\;}}{\;}$Fe(OH)3(胶体)+3HCl.①当溶液呈红褐色时,停止加热,即制得Fe(OH)3胶体.
②氢氧化铁胶体粒子直径大小的范围是1~100 nm.
③下列叙述错误的是B.
A.雾属于胶体,能产生丁达尔效应.
B.“PM2.5”悬浮在空气中形成胶体,危害人体健康(“PM2.5”指大气中直径小于或等于2.5微米的细小颗粒物,也可称为可吸入肺颗粒物)
C.明矾、硫酸铁可以净水,净水原理和胶体有关
D.胶体在一定条件下能稳定存在,属于介稳体系.
分析 ①制备氢氧化铁胶体,可将饱和氯化铁滴加到沸水中,并加热至溶液呈红褐色;
②胶体分散质粒子的直径在1nm~100nm之间;
③A.雾分散质粒子直径在1nm~100nm之间;
B.胶体的微粒直径在1-100nm之间;
C.明矾净水是氢氧化铝净水;硫酸铁是氢氧化铁净水;
D.胶体是介稳分散系.
解答 解:①制备氢氧化铁胶体,可将饱和氯化铁滴加到沸水中,并加热至溶液呈红褐色,因胶体在加热易聚沉,当溶液呈红褐色停止加热,故答案为:红褐色;
②氢氧化铁胶体分散质粒子的直径在1nm~100nm之间,故答案为:1~100 nm;
③A.雾分散质粒子直径在1nm~100nm之间,是胶体,产生丁达尔现象,故A正确;
B.PM2.5的直径大于胶体直径,所以不属于胶体,故B错误;
C.明矾净水是铝离子水解生成的氢氧化铝具有净水作用,硫酸铁净水是铁离子水解生成的氢氧化铁具有净水作用,故C正确;
D.胶体是介稳分散系,在一定条件下能稳定存在,故D正确.
故答案为:B.
点评 本题考查了胶体微粒直径大小的分析判断,胶体性质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4.胃药“达喜”中含有碳酸镁(MgCO3).碳酸镁属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
10.下列说法或判断正确的是( )
| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
17.阿伏加德罗曾做过这样一个实验:一个抽空的密闭容器重Mg,在标准状况下,盛满CH4气体,称量为(M+Q)g,把CH4气体排尽,再充入SO2气体,称得的质量为( )
| A. | M+2Q | B. | M+4Q | C. | 2Q | D. | 2M+2Q |
14.醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:
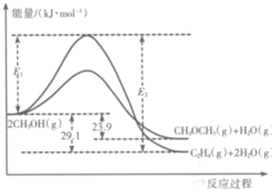
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:

(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
11.将质量分数为a%物质的量浓度为C1的KOH溶液蒸发掉一部分水,使其质量分数变为2a%,此时它的物质的量浓度相应变为C2,则C1和C2的数值关系是( )
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |