题目内容
12.含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol•L-1的Cr2O72-.为了使废水的排放达标,进行如下处理: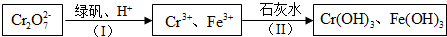
①绿矾化学式为FeSO4•7H2O.反应(I)的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
②若处理后的废水中c(Cr3+)=3.0×10-6 mol•L-1,则废水中c(Fe3+)=2.0×10-13 mol•L-1.(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
分析 由流程可知,Cr2O72-与亚铁离子发生氧化还原反应生成铁离子、铬离子,然后与石灰水反应转化为沉淀,从而达到废水处理的要求.
①结合电子、电荷守恒分析;
②结合c(Cr3+)及Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)计算c3(OH-),再利用Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)计算的c(Fe3+).
解答 解:由流程可知,Cr2O72-与亚铁离子发生氧化还原反应生成铁离子、铬离子,然后与石灰水反应转化为沉淀,从而达到废水处理的要求.
①绿矾化学式为FeSO4•7H2O,反应(I)发生氧化还原反应,由电子和电荷守恒可知离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol•L-1,Ksp[Cr(OH)3]=6.0×10-31,
则c3(OH-)=$\frac{6.0×1{0}^{-31}}{3.0×1{0}^{-6}}$=2.0×10-25,
由Ksp[Fe(OH)3]=4.0×10-38可知,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-25}}$=2.0×10-13mol/L,
故答案为:2.0×10-13.
点评 本题考查混合物分离提纯及溶度积计算,为高频考点,把握流程中的反应及Ksp的计算为解答的关键,侧重分析与计算、实验能力的考查,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
3.实验中的下列操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏操作时,温度计的水银球要插入溶液中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出 |
20.已知三种酸HA、HB、HC的电离常数分别为a、b、c,且a>b>c,则对相同浓度的酸溶液叙述正确的是( )
| A. | HC的电离度最大 | |
| B. | HA溶液酸性最强 | |
| C. | HC溶液酸性最强 | |
| D. | 三种溶液中酸的电离程度:HA<HB<HC |
7.下列操作属于萃取的是( )
| A. | 向溴的煤油溶液里加入苯震荡 | B. | 向溴水里加入酒精后震荡 | ||
| C. | 向碘的四氯化碳的溶液里加水震荡 | D. | 向碘水里加入四氯化碳后震荡 |
17.被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O═NaBO2Z+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( )
| A. | 被氧化的元素与被还原的元素质量比为1:1 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | NaBH4即使氧化剂又是还原剂 |
4.室温下,某实验小组的同学将0.1mol/L的一元酸HA溶液和0.1mol/L的KOH溶液混合(忽略体积变化),实验数据如下表所示,下列判断一定正确的是( )
| 实验编号 | 溶液体积(mL) | 反应后溶液的pH | |
| HA | KOH | ||
| ① | 10 | 10 | |
| ② | 10 | a | 7 |
| A. | 实验①所得的混合溶液中:c(K+)>c(A-)>c(H+)>c(OH-) | |
| B. | 实验①所得的混合溶液中:c(OH-)+c(A-)=c(K+)+c(H+) | |
| C. | 实验②所得的混合溶液中:c(A-)+c(HA)=0.1mol•L-1 | |
| D. | 实验②所得的混合溶液中:(K+)>c(A-)>c(OH-)=c(H+) |
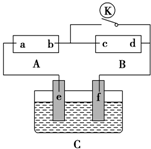 如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空:
如图所示,A为直流电源,B为浸透饱和硫酸钠溶液和紫色石蕊溶液的滤纸,C为电镀池,接通电路后,发现B上的c点显蓝色,请填空: