题目内容
5.现有A、B、C、D.E.F六种短周期主族元素,它们的原子序数依次增大.A、D同主族,C、E同主族,D、E、F同周期.A、B的原子最外层电子数之和与C原子的最外层电子数相等.A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子(题中的字母只代表元素代号,与实际元素符号无关).请回答下列问题:(1)A~F六种元素原子,原子半径最大的是Na(填对应的元素符号).
(2)A与B两种元素组成一种阳离子,该离子符号为NH4+.
(3)C、D两种元素组成的化合物的化学式是Na2O、Na2O2.
(4)E.F两种元素中非金属性较强的是Cl,能够证明这一结论的化学事实是高氯酸的酸性比硫酸的酸性强.
分析 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,则A为H元素,C为O元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,D、E、F同周期,则D为Na,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素.
解答 解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,则A为H元素,C为O元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,D、E、F同周期,则D为Na,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述A~F六种元素原子,原子半径最大的是Na,故答案为:Na;
(2)A与B两种元素组成一种阳离子,该离子符号为NH4+,故答案为:NH4+;
(3)C、D两种元素组成的化合物的化学式是Na2O、Na2O2,故答案为:Na2O、Na2O2;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>S,能够证明这一结论的化学事实是:高氯酸的酸性比硫酸的酸性强,
故答案为:Cl;高氯酸的酸性比硫酸的酸性强.
点评 本题考查位置结构性质的关系及应用,推断元素的推断是解题的关键,A与C形成的化合物常温下为液态是推断突破口,注意掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.肉桂醛常用于牙膏、口香糖、口气清新剂等口腔护理品,其结构简式如图所示.工业上电解肉桂醇制备肉桂醛,下列说法不正确的是( )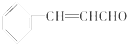
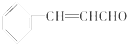
| A. | 煮沸肉桂醛与新制Cu(OH)2的混合物有砖红色沉淀生成 | |
| B. | 电解肉桂醇制得的肉桂醛在电解池的阳极生成 | |
| C. | 仅用新制银氨溶液和溴水不能鉴别肉桂醛中的碳碳双键 | |
| D. | 13.2g肉桂醛分子中含有碳碳双键数目为0.4NA |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g氮气含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的水分子数为NA | |
| C. | 1molOH-含有的电子数为10NA | |
| D. | 0.1L 1mol/L NaCl溶液中含有Na+个数为NA |
20.云母属于晶体,用烧热了的钢条去接触涂油薄薄一层石蜡的云母片反面时,熔化了的石蜡呈现椭圆形,这是因为( )
| A. | 云母是热的不良导体.传热不均匀 | |
| B. | 石蜡是热的不良导体.传热不均匀 | |
| C. | 石蜡具有各向异性,不同的方向导热性不同 | |
| D. | 云母具有各向异性,不同的方向导热性不同 |
5.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①计算该反应第一次达平衡时的平衡常数K0.135
②3min时改变的反应条件是升高温度或增大H2O的浓度或减小CO的浓度 (只填一种条件的改变即可).
(3)已知温度、压强、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O}$]对该反应的影响如图所示.
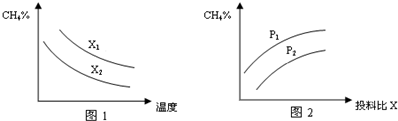
①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
②3min时改变的反应条件是升高温度或增大H2O的浓度或减小CO的浓度 (只填一种条件的改变即可).
(3)已知温度、压强、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O}$]对该反应的影响如图所示.

①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
3.实验中的下列操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏操作时,温度计的水银球要插入溶液中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出 |
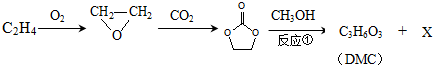
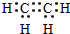 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解

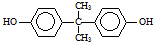 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: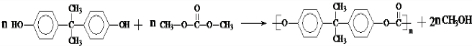 .
.