题目内容
10.在硫酸溶液中,NaClO3和Na2SO3能按物质的量之比l:2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4,则X为( )| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
分析 Na2SO3被氧化为Na2SO4,Na2SO3是还原剂,NaClO3中氯元素的化合价由+5价降低,NaClO3为氧化剂,根据电子转移守恒计算Cl元素在还原产物中的化合价,进而判断产物.
解答 解:Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价,NaClO3中氯元素的化合价由+5价降低,NaClO3为氧化剂,令Cl元素在还原产物中的化合价为a,则:2×(6-4)=1×(5-a),解得a=1,故棕黄色气体X的化学式为Cl2O,
故选B.
点评 本题考查氧化还原反应的有关计算,难度不大,注意从化合价变化判断氧化剂、还原剂、氧化产物、还原产物等概念,利用电子转移守恒计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 大理石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁和稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 稀硫酸和氨水:H++NH3•H2O═NH4++H2O | |
| D. | 碳酸氢钙溶液和盐酸:HCO3-+H+═H2O+CO2↑ |
18.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 88.0g 干冰中含有的电子数为8.0NA | |
| B. | 常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA | |
| C. | 常温下1.0L0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| D. | 1.2g金刚石中含有的碳碳键数为0.4NA |
5.已知氧化性:Cl2>Fe3+>S,则下列说法正确的是( )
| A. | Fe可以和S在加热条件下生成Fe2S3 | |
| B. | Cl2和H2S相遇可发生反应:H2S+Cl2═2HCl+S↓ | |
| C. | 在酸性溶液中,Fe3+和S2-可以大量共存 | |
| D. | Cl2可以氧化Fe3+ |
15.在一定温度下,将nmolPCl5通入定容的密闭容器中,达平衡,反应为:PCl5(g)?PCl3(g)+Cl2(g),测得压强为P1,若再向容器中通入nmolPCl5,又达平衡后,压强为P2,则下列关系式正确的是( )
| A. | P1=2P2 | B. | 2P1=P2 | C. | P1<P2<2P1 | D. | 2P1<P2 |
2.以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体总体积V(g)(标准状况)的关系如图所示.下列说法中(忽略溶液体积变化)正确的是( )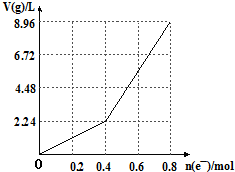

| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)═2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
20.相同温度,相同物质的量浓度的五种溶液.按pH由大到小的顺序排列,正确的是( )
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
| A. | ⑤>④>①>③>② | B. | ⑤>④>③>①>② | C. | ⑤>④>①>②>③ | D. | ④>⑤>③>①>② |