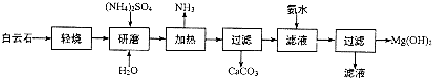
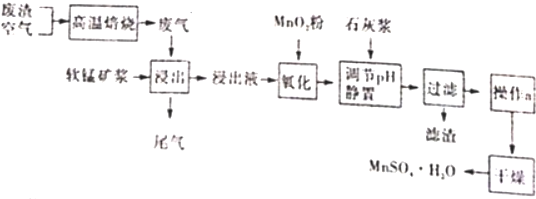
题目内容
9.常温下,下列各组离了在指定溶液中一定能大量共存的是( )| A. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| B. | 1.Omol•L-1的HNO3溶液:K+、Fe2+、Cl-、SO42- | |
| C. | 1.Omol•L-1 的KI溶液:Na+、Fe3+、Cl-、SO42- | |
| D. | l.Omo•L-1的 CaCl2溶液:Na+、K+、Cl-、CO32- |
分析 A.四种离子之间不反应,能够共存;
B.硝酸具有强氧化性,能够氧化亚铁离子;
C.铁离子能够氧化碘离子;
D.碳酸根离子与氯化钙反应生成碳酸钙沉淀.
解答 解:A.Cu2+、SO42-、Mg2+、Cl-之间不发生反应,能够大量共存,故A正确;
B.HNO3溶液能够氧化Fe2+,在溶液中不能大量共存,故B错误;
C.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.CaCl2与CO32-之间反应生成碳酸钙沉淀,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.相同温度,相同物质的量浓度的五种溶液.按pH由大到小的顺序排列,正确的是( )
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
| A. | ⑤>④>①>③>② | B. | ⑤>④>③>①>② | C. | ⑤>④>①>②>③ | D. | ④>⑤>③>①>② |
4.常温下,某溶液A中可能含有NH4+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行相关实验,实验结果如图所示,下列有关说法正确的是( )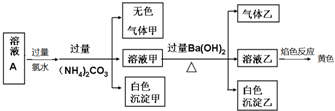

| A. | 溶液中一定有SO42-,可能有Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
1.下列说法正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 燃烧热是指可燃物热化学反应方程式中的△H | |
| C. | 用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 醋酸溶液的导电能力可能比稀硫酸强 |
18.下列事实不能用电化学理论解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 银制奖牌久置后表面变暗 |