题目内容
11. 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:①在天平上称出14.2g 硫酸钠固体,把它放在烧杯中里,用适量的蒸馏水使它完全溶解.②把制得的溶液小心地注入500mL容量瓶中.③继续向容量瓶中加蒸馏水至液面距刻度1cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切.④用少量蒸馏水洗烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀. ⑤将容量瓶塞塞紧,充分摇匀.请填写下列空白:
(1)操作步骤的正确顺序为(填序号)①②④③⑤.
(2)本实验用到的玻璃仪器主要有500 mL容量瓶、烧杯、玻璃棒、胶头滴管.
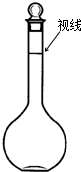
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会偏高(填“偏高”、“偏低”、“无影响”,下同).
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会偏低;加蒸馏水时不慎超过了刻度线,会偏低.
分析 (1)依据配制一定物质的量浓度溶液的一般操作步骤排序;
(2)依据配制一定物质的量浓度溶液的一般操作步骤选择需要的仪器;
(3)俯视刻度线线,导致溶液体积偏小,依据C=$\frac{n}{V}$判断溶液浓大小;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般操作步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:①②④③⑤;
故答案为:①②④③⑤;
(2)配制一定物质的量浓度溶液的一般操作步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器主要有:500 mL容量瓶;烧杯;玻璃棒;胶头滴管;
故答案为:500 mL容量瓶;烧杯;玻璃棒;胶头滴管;
(3)该同学观察液面时俯视刻度线,导致溶液体积偏小,依据c=$\frac{n}{V}$可知溶液浓度偏高,故答案为:偏高;
(4)没有进行操作步骤④,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
加蒸馏水时不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;偏低.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意容量瓶的使用方法和误差分析的方法,题目难度不大.

练习册系列答案
相关题目
1.常温下,下列指定溶液中一定能大量共存的是( )
| A. | 无色透明溶液中:K+、Cu2+、SO42-、Na+ | |
| B. | pH=12的溶液中:K+、Na+、SO42-、CH3COO-、CO32- | |
| C. | 加入铝片能放出H2的溶液中:Na+、HCO3-、Cu2+、SO42- | |
| D. | 由水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Ba2+、NO3-、Cl- |
19.体积为VL、密度为ρg/cm3的某溶液中,含有摩尔质量为M的溶质的质量是m.若此溶液中溶质的物质的量浓度为c,溶质的质量分数为w,则下列各表示式中,正确的是( )
| A. | c=$\frac{ρ•w}{M}$ | B. | c=$\frac{ρ•M}{w}$ | C. | c=$\frac{M}{m•V}$ | D. | c=$\frac{m}{M•V}$ |
6.下列有关Na+离子的叙述中正确的是( )
| A. | 有碱性 | B. | 有强氧化性 | C. | 有强还原性 | D. | 很难被还原 |
3.有关氨及氨水的说法,正确的是( )
| A. | NH3具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | 氨水的主要成分是NH3 |
3.下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 | |
| C. | 1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2gFe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |