题目内容
3.有关氨及氨水的说法,正确的是( )| A. | NH3具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | 氨水的主要成分是NH3 |
分析 A.依据氨气中氮元素化合价判断;
B.氨水是混合物;
C.电解质必须是化合物;
D.氨水的主要成分是一水合氨.
解答 解:A.氨气中氮元素化合价为-3价,为最低价,具有还原性,故A正确;
B.液氨、氨气是纯净物,氨水是混合物,不是同种物质,故B错误;
C.氨水是混合物,既不是电解质,也不是非电解质,故C错误;
D.氨水的主要成分是一水合氨,故D错误;
故选:A.
点评 本题考查了氨气的性质,熟悉电解质、混合物、纯净物的概念是解题关键,题目难度不大.

练习册系列答案
相关题目
13.已知热化学方程式:
①C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H1=-1301.0kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
①C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H1=-1301.0kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
| A. | +228.2 kJ•mol-1 | B. | -228.2 kJ•mol-1 | ||
| C. | +1 301.0 kJ•mol-1 | D. | +621.7 kJ•mol-1 |
14.同温同压下,分子数相同的氨气和氢气,它们( )
| A. | 所占的体积相同 | B. | 密度相同 | ||
| C. | 所含原子数目相同 | D. | 所占体积一定是22.4L |
15.在下列条件下的离子组一定能够大量共存的是( )
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 含有大量H+的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 某无色溶液中:Na+、Al3+、Cl-、HCO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol•L-1的无色溶液中:K+、Na+、Cl-、NO3- |
15.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 |
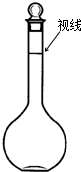 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有: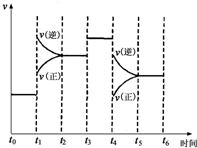 如图表示反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.在某段时间t0~t6中反应速率与反应过程的曲线图
如图表示反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.在某段时间t0~t6中反应速率与反应过程的曲线图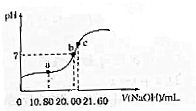 草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.
草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用. 如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的数据,请根据有关数据回答下列问题: