题目内容
广泛存在于水果内的某有机物A是一种常用的食品添加剂.与A相关的反应如图: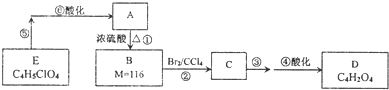
已知:i、在25℃时,A的电离平衡常数KA=3.9×10-4,K2=5.5×10-6
ii、A分子的核磁共振氢谱有5个吸收峰
iii、1molA
共产生1.5mol气体
iv、1molA充分燃烧后,生成4molCO2和3molH2O的总质量比A增加96g.请按要求回答下列问题:
(1)A的分子式 ,它具有的官能团名称: .
(2)反应①的反应类型: ;反应②的反应类型: ;反应③的反应条件是: .
(3)D的结构简式: .
(4)反应⑤的化学方程式: .
(5)在浓硫酸、加热条件下,B与乙二醇等物质的量进行缩聚反应,生成的高分子化合物用于制造玻璃钢.写出该反应的化学方程式: .
(6)有机物F是A的同分异构体:它的核磁共振氢谱有2组峰,峰面积之比为1:2;它的红外光谱表明没有连氧(如“-O-O-”等)、碳碳双键红外吸收峰.符合上述条件F所有的链状结构有 种,写出其中一种的结构简式 .

已知:i、在25℃时,A的电离平衡常数KA=3.9×10-4,K2=5.5×10-6
ii、A分子的核磁共振氢谱有5个吸收峰
iii、1molA
| 足量钠 |
iv、1molA充分燃烧后,生成4molCO2和3molH2O的总质量比A增加96g.请按要求回答下列问题:
(1)A的分子式
(2)反应①的反应类型:
(3)D的结构简式:
(4)反应⑤的化学方程式:
(5)在浓硫酸、加热条件下,B与乙二醇等物质的量进行缩聚反应,生成的高分子化合物用于制造玻璃钢.写出该反应的化学方程式:
(6)有机物F是A的同分异构体:它的核磁共振氢谱有2组峰,峰面积之比为1:2;它的红外光谱表明没有连氧(如“-O-O-”等)、碳碳双键红外吸收峰.符合上述条件F所有的链状结构有
考点:有机物的推断
专题:
分析:1molA充分燃烧后,生成4molCO2和3molH2O,A分子中含有4个碳原子、6个氢原子,而二氧化碳、水的总质量比A增加96g,增加为氧原子质量,物质的量为
=6mol,设A分子中氧原子数目为n,则4mol×2+3mol-nmol=6mol,故n=5,则A分子式为C4H6O5,不饱和度为
=2,结合A的电离平衡常数,可知A为二元弱酸,1mol A与足量的金属钠反应产生1.5mol H2,则A分子中含有一个羟基和二个羧基,核磁共振氢谱表明A分子有5个吸收峰,则A的结构简式为:HOOCCH(OH)CH2COOH,E在氢氧化钠水溶液、加热条件下发生水解反应、酸化得到A,故E为HOOCCH(Cl)CH2COOH,由A与B的相对分子质量可知,A发生消去反应生成B为HOOCCH=CHCOOH,B与溴发生加成反应生成C为HOOCCH(Br)CH(Br)COOH,结合D的分子式可知,C在氢氧化钠醇溶液、加热条件下发生消去反应,再酸化得到D为HOOCC≡CCOOH,据此解答.
| 96g |
| 16g/mol |
| 2×4+2-6 |
| 2 |
解答:
解:1molA充分燃烧后,生成4molCO2和3molH2O,A分子中含有4个碳原子、6个氢原子,而二氧化碳、水的总质量比A增加96g,增加为氧原子质量,物质的量为
=6mol,设A分子中氧原子数目为n,则4mol×2+3mol-nmol=6mol,故n=5,则A分子式为C4H6O5,不饱和度为
=2,结合A的电离平衡常数,可知A为二元弱酸,1mol A与足量的金属钠反应产生1.5mol H2,则A分子中含有一个羟基和二个羧基,核磁共振氢谱表明A分子有5个吸收峰,则A的结构简式为:HOOCCH(OH)CH2COOH,E在氢氧化钠水溶液、加热条件下发生水解反应、酸化得到A,故E为HOOCCH(Cl)CH2COOH,由A与B的相对分子质量可知,A发生消去反应生成B为HOOCCH=CHCOOH,B与溴发生加成反应生成C为HOOCCH(Br)CH(Br)COOH,结合D的分子式可知,C在氢氧化钠醇溶液、加热条件下发生消去反应,再酸化得到D为HOOCC≡CCOOH,
(1)由上述分析可知,A的分子式为C4H6O5,结构简式为:HOOCCH(OH)CH2COOH,含有官能团为羧基、羟基,故答案为:C4H6O5;羧基、羟基;
(2)反应①是A醇发生的消去反应生成B,反应②是碳碳双键与溴发生的加成反应,反应③是卤代烃的消去反应,反应条件是:氢氧化钠醇溶液、加热,故答案为:消去反应;加成反应;氢氧化钠醇溶液、加热;
(3)由于上述分析可知,D的结构简式为:HOOCC≡CCOOH,故答案为:HOOCCHHOOCC≡CCOOH;
(4)反应⑤的化学方程式为:HOOCCH(Cl)CH2COOH+3NaOH
NaOOCCH(OH)CH2COONa+NaCl+2H2O,
故答案为:HOOCCH(Cl)CH2COOH+3NaOH
NaOOCCH(OH)CH2COONa+NaCl+2H2O;
(5)在催化剂作用下,HOOCCH=CHCOOH与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.该反应的化学方程式为:n +n HOCH2CH2OH
+n HOCH2CH2OH
 +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n +n HOCH2CH2OH
+n HOCH2CH2OH
 +(2n-1)H2O;
+(2n-1)H2O;
(6)有机物F是A的同分异构体:它的核磁共振氢谱有2组峰,峰面积之比为1:2;它的红外光谱表明没有连氧(如“-O-O-”等)、碳碳双键红外吸收峰,符合条件的F的结构简式有:HOOCCH2OCH2COOH、 ,故答案为:3;HOOCCH2OCH2COOH等.
,故答案为:3;HOOCCH2OCH2COOH等.
| 96g |
| 16g/mol |
| 2×4+2-6 |
| 2 |
(1)由上述分析可知,A的分子式为C4H6O5,结构简式为:HOOCCH(OH)CH2COOH,含有官能团为羧基、羟基,故答案为:C4H6O5;羧基、羟基;
(2)反应①是A醇发生的消去反应生成B,反应②是碳碳双键与溴发生的加成反应,反应③是卤代烃的消去反应,反应条件是:氢氧化钠醇溶液、加热,故答案为:消去反应;加成反应;氢氧化钠醇溶液、加热;
(3)由于上述分析可知,D的结构简式为:HOOCC≡CCOOH,故答案为:HOOCCHHOOCC≡CCOOH;
(4)反应⑤的化学方程式为:HOOCCH(Cl)CH2COOH+3NaOH
| 水 |
| △ |
故答案为:HOOCCH(Cl)CH2COOH+3NaOH
| 水 |
| △ |
(5)在催化剂作用下,HOOCCH=CHCOOH与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.该反应的化学方程式为:n
 +n HOCH2CH2OH
+n HOCH2CH2OH| 一定条件 |
 +(2n-1)H2O,
+(2n-1)H2O,故答案为:n
 +n HOCH2CH2OH
+n HOCH2CH2OH| 一定条件 |
 +(2n-1)H2O;
+(2n-1)H2O;(6)有机物F是A的同分异构体:它的核磁共振氢谱有2组峰,峰面积之比为1:2;它的红外光谱表明没有连氧(如“-O-O-”等)、碳碳双键红外吸收峰,符合条件的F的结构简式有:HOOCCH2OCH2COOH、
 ,故答案为:3;HOOCCH2OCH2COOH等.
,故答案为:3;HOOCCH2OCH2COOH等.
点评:本题考查有机物的推断,确定A的结构简式是关键,再结合反应条件与有机物分子式进行推断,侧重于学生的分析能力的考查,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(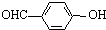 )和邻羟基苯甲醛( )和邻羟基苯甲醛(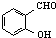 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
以下说法:①SO2、SiO2、CO均为酸性氧化物
②KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
③碱性氧化物一定是金属氧化物
④硫酸、火碱、纯碱、生石灰分别属于酸、碱、盐和氧化物
⑤二氧化硅的分子式为SiO2,酸性氧化物,能与NaOH溶液反应
⑥正四面体分子中键角一定是109°28′
⑦CO2 与SiO2化学性质相似物理性质也相似
⑧福尔马林、水玻璃、氨水均为混合物
⑨强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
其中正确的是( )
②KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
③碱性氧化物一定是金属氧化物
④硫酸、火碱、纯碱、生石灰分别属于酸、碱、盐和氧化物
⑤二氧化硅的分子式为SiO2,酸性氧化物,能与NaOH溶液反应
⑥正四面体分子中键角一定是109°28′
⑦CO2 与SiO2化学性质相似物理性质也相似
⑧福尔马林、水玻璃、氨水均为混合物
⑨强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
其中正确的是( )
| A、①③④⑤⑥ | B、④⑥⑧⑨ |
| C、③④⑧ | D、②④⑦⑨ |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、Cu |
| C、NaCl |
| D、酒精 |

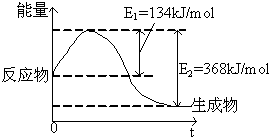 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.