题目内容
向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到剩余固体物质的组成是( )
| A、NaCl、NaBr、Na2SO4 |
| B、NaCl、Na2SO4 |
| C、NaCl、Na2SO4、I2 |
| D、NaCl、NaI、Na2SO4 |
考点:氯气的化学性质
专题:卤族元素
分析:在Br-、I-、SO32-中,还原性由弱到强为Br-<I-<SO32-,向含有NaBr和NaI、Na2S03的混合溶液中通入过量氯气发生:Cl2+Na2SO3+H2O=Na2SO4+2HCl、2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,结合Br2和I2的性质分析.
解答:
解:向含有NaBr和NaI、Na2S03的混合溶液中通入过量氯气发生:Cl2+Na2SO3+H2O=Na2SO4+2HCl、2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,
加热时,Br2、HCl易挥发,I2易升华,最后所得固体只有NaCl和Na2SO4,
故选B.
加热时,Br2、HCl易挥发,I2易升华,最后所得固体只有NaCl和Na2SO4,
故选B.
点评:本题考查卤素知识,明确离子反应先后顺序及生成物的性质是解本题关键,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列反应的离子方程式中正确的是( )
| A、硫酸亚铁溶液中加入用硫酸酸化过的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
| B、过量的二氧化硫通入漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3 |
| C、向氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
在一定温度下,反应A2(气)+B2(气)?2AB(气)达到平衡的标志是( )
| A、单位时间生成n mol的A2同时生成n mol的AB |
| B、容器内的总压强不随时间变化 |
| C、单位时间生成2n mol的AB同时生成n mol的B2 |
| D、单位时间生成n mol的A2同时生成n mol的B2 |
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(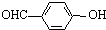 )和邻羟基苯甲醛( )和邻羟基苯甲醛(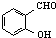 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
以下说法:①SO2、SiO2、CO均为酸性氧化物
②KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
③碱性氧化物一定是金属氧化物
④硫酸、火碱、纯碱、生石灰分别属于酸、碱、盐和氧化物
⑤二氧化硅的分子式为SiO2,酸性氧化物,能与NaOH溶液反应
⑥正四面体分子中键角一定是109°28′
⑦CO2 与SiO2化学性质相似物理性质也相似
⑧福尔马林、水玻璃、氨水均为混合物
⑨强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
其中正确的是( )
②KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
③碱性氧化物一定是金属氧化物
④硫酸、火碱、纯碱、生石灰分别属于酸、碱、盐和氧化物
⑤二氧化硅的分子式为SiO2,酸性氧化物,能与NaOH溶液反应
⑥正四面体分子中键角一定是109°28′
⑦CO2 与SiO2化学性质相似物理性质也相似
⑧福尔马林、水玻璃、氨水均为混合物
⑨强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
其中正确的是( )
| A、①③④⑤⑥ | B、④⑥⑧⑨ |
| C、③④⑧ | D、②④⑦⑨ |
近年来,食品安全领域相继发生“面粉增白剂”、“彩色馒头”、“毒豆芽”、“牛肉膏”、“硫黄姜”、“地沟油”等事件,温家宝总理痛斥不法分子“道德素质严重滑坡”.下列有关说法错误的是( )
| A、对于能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,不必限量使用 |
| B、“面粉增白剂”中的CaO2具有强氧化性 |
| C、制作“毒豆芽”所用的亚硝酸钠(NaNO2)和使猪肉变“牛肉”时掺入的硼砂(Na2B4O7?10H2O)都属于钠盐 |
| D、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
 如图所示,A、B、C、D、E五种物质的相互转化关系
如图所示,A、B、C、D、E五种物质的相互转化关系