题目内容
往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式正确的是( )
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:少量Ba(OH)2溶液,铵根离子不参加反应,而足量Ba(OH)2溶液,铵根离子、氢离子、硫酸根离子均反应,以此来解答.
解答:
解:若少量Ba(OH)2溶液,离子反应为2H++2SO42-+2Ba2++2OH-=2BaSO4↓+2H2O,
若足量Ba(OH)2溶液,铵根离子、氢离子、硫酸根离子均反应,离子反应为NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O,
故选C.
若足量Ba(OH)2溶液,铵根离子、氢离子、硫酸根离子均反应,离子反应为NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O,
故选C.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查,题目难度不大.

练习册系列答案
相关题目
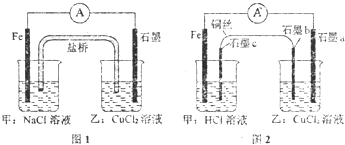 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率随时间的变化如图所示:下列说法中正确的是( )


| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(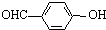 )和邻羟基苯甲醛( )和邻羟基苯甲醛(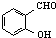 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
下列物质中,属于电解质的是( )
| A、CO2 |
| B、Cu |
| C、NaCl |
| D、酒精 |
在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.2mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.2 mol?L-1 |
| B、Y2为0.35 mol?L-1 |
| C、X2为0.3 mol?L-1 |
| D、Z为0.4 mol?L-1 |
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
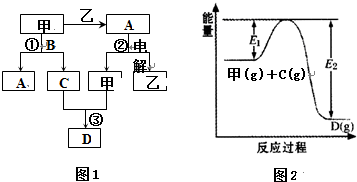
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表: 已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:
已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题: