题目内容
13.我国国家标准( GB2760 )明确规定:葡萄酒中SO2最大使用量为0.25g•L-1.某校化学探究性活动小组的同学用图1装置(夹持装置略去)收集某葡萄酒中SO2,并对其含量进行测定.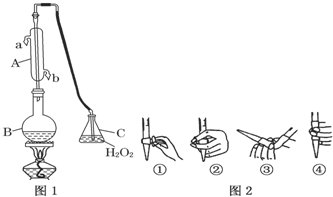
(1)仪器A的名称是水冷凝管,水通入A的进口为b(选填“a”或“b”).
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为SO2+H2O2=H2SO4.
(3)除去C中过量的H2O2,然后用0.090 0mol•L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的③;若滴定终点时溶液的pH=8.8,则应该选择的适宜指示剂为酚酞;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处,则管内液体的体积(填序号)④(选填①=10mL,②=40mL,③<10mL,④>40mL).
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为0.24g•L-1.
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施盐酸的挥发;用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是AD.
A.c(Na+)=c(HSO3-)+2c(SO32-)
B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+)=c(OH-)
C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+)>c(HSO3-)+c(SO32-)+c(H2SO3)
分析 (1)根据仪器A的形状和用途分析为冷凝管,仪器A特点和用途分析,为了充分冷却气体,应该逆流;
(2)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的离子方程式;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,据此计算;
(4)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,c(H+)=c(OH-),结合溶液在电弧守恒,元素守恒、电离平衡常数分析判断.
解答 解:(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
故答案为:冷凝管;b;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0);若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以④正确,
故答案为:③;酚酞;④;
(4)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×0.0900mol/L×0.025L×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.072g}{0.3L}$=0.24g/L,
故答案为:0.24;
(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:盐酸的挥发;用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验;
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,c(H+)=c(OH-),
A.依据溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),得到c(Na+)=c(HSO3-)+2c(SO32-),故A正确;
B.若c(HSO3-)=c(SO32-),溶液呈酸性c(H+)>c(OH-),故B错误;
C.物料守恒可知亚硫酸氢钠和亚硫酸钠按照1:1混合,溶液呈碱性,溶液中物料守恒为《2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-),但溶于呈中性,亚硫酸氢钠和亚硫酸钠不同,故C错误;
D.依据化学式可知,亚硫酸氢钠中硫元素物质的量和钠物质的量相同,亚硫酸钠中钠离子大于亚硫酸根中硫元素,所以c(Na+)>c(HSO3-)+c(SO32-)+c(H2SO3),故D正确;
故答案为:AD.
点评 本题考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生的分析能力及化学实验能力.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | 0.1mol/L稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2 NA | |
| D. | 标准情况下,22.4LCl2和HCl的混合气体中含分子总数为NA |
| A. | 实验室里易燃试剂与强氧化性试剂应分开放置并远离火源 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 滴定实验中所用到的滴定管和移液管,在使用前均需干燥或用相应的溶液润洗,容量瓶、锥形瓶则不应润洗 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
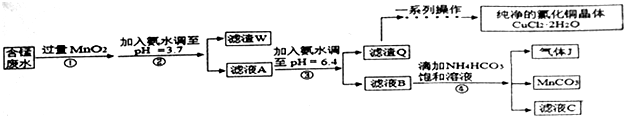
 用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )| A. | 构成原电池时b极反应为:Cu-2e-═Cu2+ | |
| B. | 构成的原电池或电解池工作后就可能产生大量气体 | |
| C. | 构成电解池时b 极质量既可能减少也可能增加 | |
| D. | 构成电解池时a极质量一定会减少 |
已知:几种金属离子沉淀的pH如表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O).
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.
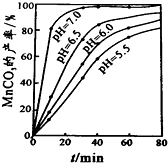
(7)从滤液C可得到的副产品是NH4Cl(填化学式).
| A. | Y元素含氧酸的酸性比W的弱 | |
| B. | Z和W在自然界均能以游离态存在 | |
| C. | YZ和YZ2均可以被NaOH溶液吸收 | |
| D. | X和Y能形成既含极性键又含非极性键的分子 |
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 不锈钢具有较强的耐腐蚀性,纯铁也有较强的耐腐蚀性 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 对石油进行分馏可以得到许多苯的同系物 |