题目内容
18.某铬盐厂净化含Cr(Ⅵ)废水并提取CrO3的一种工艺流程如下图所示
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.6×10-39
Ksp[Fe(0H)2]=4.9×10-17
(1)步聚I中,发生的反应为:2H++2CrO42-?CrO72-+H2O,B中含铬元素的离子有CrO42-、Cr2O72-(填离子符号).
(2)步骤Ⅱ中,发生反应的离子方程式为3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O.
(3)当清液中Cr3+的浓度≤1.5mg•L-1时,可认为已达铬的排放标准,若测得清液的pH=5,清液尚不符合铬的排放标准,因为此时Cr3+的浓度=327.6mg•L-1.
(4)所得产品中,Cr2O3外,还含有的杂质是CaSO4.
(5)步骤Ⅱ还可以用其他物质代替NaHSO3作还原剂.
①若用FeSO4•7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有Cr3+、Fe3+、H+(填离子符号).
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O72-)的对应关系如下表所示.

有人认为pH=6时,c(Cr2O72-)变小的原因是Cr2O72-基本上都已转化为Cr3+.这种说法说法正确,为什么?
答:不正确,C(H+)减小,化学平衡2H++2CrO42-?CrO72-+H2O向逆反应方向移动,溶液中Cr(Ⅵ)主要以CrO42-形式存在.
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能降低,需要控制的条件有铁屑过量,将溶液的PH控制在使Cr(OH)3,完全沉淀而氢氧化亚铁不沉淀的范围内.
分析 提取CrO3的工艺流程:含Cr(Ⅵ)废水A加入硫酸酸化,发生的反应为:2H++2CrO42-?CrO72-+H2O,该反应为可逆反应,所以B中含有CrO42-、Cr2O72-,加入亚硫酸氢钠,+4价的硫被+6价的铬氧化,反应为:3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O,得到溶液C,加入石灰乳,Cr3++Ca(OH)2=Cr(OH)3↓+Ca2+,氢氧化铬煅烧干化得到氧化铬,因硫酸钙微溶,所以沉淀物中含有杂质CaSO4.
(1)根据可逆反应的特点分析;
(2)因Cr元素的化合价降低,则S元素的化合价升高为SO42-,根据得失电子守恒和元素守恒配平方程式;
(3)根据溶度积常数以及水的离子积常数来进行计算,清液的pH=5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,根据c(Cr3+)=$\frac{{K}_{SP}[Cr(OH)_{3}]}{{C}^{3}(0H)}$计算出铬离子的浓度;
(4)硫酸钙微溶,沉淀物中含有杂质CaSO4;
(5)①Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为Cr3+;
②根据酸性减弱,对化学平衡2H++2CrO42-?CrO72-+H2O的影响分析;
③控制PH使Cr(OH)3,完全沉淀,但不能使氢氧化铁沉淀.
解答 解:(1)步聚I中,发生的反应为:2H++2CrO42-?CrO72-+H2O,该反应为可逆反应,可逆反应的特点为反应物和生成物共存,所以B中含有CrO42-、Cr2O72-,
故答案为:CrO42-、Cr2O72-;
(2)Cr元素的化合价从+6价降低到+3价得到3个电子,所以Cr2O72-→Cr3+得到6个电子;HSO3-→SO42-失去2个电子,所以Cr2O72-计量数是HSO3-的3倍,再根据原子守恒和电荷守恒配平其它物质的计量数;所以其方程式为3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O,
故答案为:3HSO3-+Cr2O72-+5H+=3SO42-+2Cr3++4H2O;
(3)清液的pH=5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,c(Cr3+)=$\frac{{K}_{SP}[Cr(OH)_{3}]}{{C}^{3}(0H)}$=$\frac{6.3×1{0}^{-31}}{(1{0}^{-9})^{3}}$=6.3×10-4mol/L;此时Cr3+的浓度=6.3×10-4mol/L×52g/mol≈327.6mg•L-1,
故答案为:327.6;
(4)溶液C,加入石灰乳,Cr3++Ca(OH)2=Cr(OH)3↓+Ca2+,氢氧化铬煅烧干化得到氧化铬,因硫酸钙微溶,所以沉淀物中含有杂质CaSO4,
故答案为:CaSO4;
(5)①用FeSO4•7H2O作还原剂,发生反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,反应后的阳离子有Cr3+、Fe3+、H+,步骤Ⅲ中加入石灰乳,氢氧根离子和三价铬形成氢氧化铬沉淀,三价铁和氢氧根离子形成氢氧化铁沉淀,氢离子和碱中和,所以步骤Ⅲ中参加反应的阳离子一定有Cr3+、Fe3+、H+,
故答案为:Cr3+、Fe3+、H+;
②根据pH与c(Cr2O72-)的对应关系图可知,pH=6时,C(H+)减小,化学平衡2H++2CrO42-?CrO72-+H2O向逆反应方向移动,溶液中Cr(Ⅵ)主要以CrO42-形式存在,所以该说法不正确,
故答案为:不正确,C(H+)减小,化学平衡2H++2CrO42-?CrO72-+H2O向逆反应方向移动,溶液中Cr(Ⅵ)主要以CrO42-形式存在;
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能降低,需将溶液的PH控制在使Cr(OH)3,完全沉淀而氢氧化亚铁不沉淀的范围内,
故答案为:铁屑过量,将溶液的PH控制在使Cr(OH)3,完全沉淀而氢氧化亚铁不沉淀的范围内.
点评 本题考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等.

| A. | HCl和H2O | B. | O2和H2O | C. | NH3和H2O | D. | CO2和NaOH溶液 |
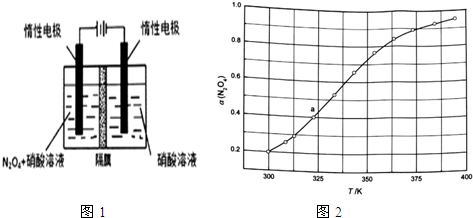
(l)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为N2O4+2HNO3-2e-═2N2O5+2H+.
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)?N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=△H=△H2-$\frac{1}{2}$△H1-△H3-$\frac{1}{2}$△H4.
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
1.00~3.00min内,O2的平均反应速率为0.090mol•L-1•min-1.
(3)从N2O4与NO2之间存在反应N2O4?2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)?2NO2(g)是吸热反应还是放热反应,说明理由吸热反应,温度升高,α(N2O4)增加,说明平衡右移,若要提高N2O4转化率,除改变反应温度外,其他措施有减小体系压强、移出NO2(要求写出两条).
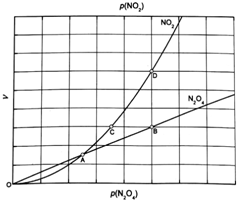
③对于反应N2O4(g)?2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2[p(NO2)]2.其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2.Kp,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由B点与D点,满足平衡条件υ(NO2)=2υ(N2O4).
| A. | 麦芽糖和蔗糖 | B. | 与 CH3-CH2-CH2-CH3 与 | ||
| C. | C2H6与C3H8 | D. | O2与O3 |
| A. | 0.1mol/L稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2 NA | |
| D. | 标准情况下,22.4LCl2和HCl的混合气体中含分子总数为NA |
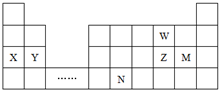
| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
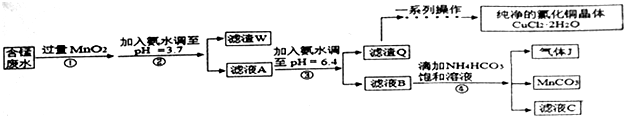
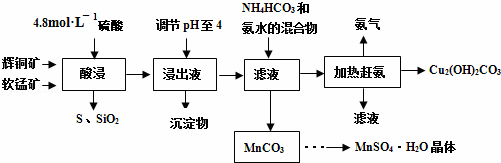
已知:几种金属离子沉淀的pH如表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O).
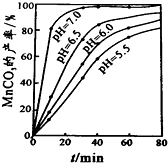
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.
(7)从滤液C可得到的副产品是NH4Cl(填化学式).