题目内容
 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol?L-1、0.002mol?L-1;
②所用H2C2O4溶液的浓度可选择:0.2mol?L-1、0.4mol?L-1;
③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:
| KMnO4酸性溶液浓度 (mol?L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论.某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论.
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol?L-1 | 体积(mL) | 浓度/mol?L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5.与KMnO4反应时,它将转化为CO2和H2O.
①草酸与酸性高锰酸钾溶液反应的离子方程式为
②室温下,0.1mol?L-1 KHC2O4酸溶液中pH<7,理由是
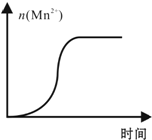
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:(1)所做的实验至少有对比实验、改变浓度的实验、改变温度的实验、加催化剂的实验;
(2)①根据v=
计算;
②比较溶液的褪色时间,高锰酸钾酸性溶液的浓度应一致,H2C2O4溶液的浓度应不同;
(3)①在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,据此写出离子方程式;
②从HC2O4-电离程度和水解程度分析;
(4)根据浓度、温度、催化剂对化学反应速率的影响分析.
(2)①根据v=
| △c |
| △t |
②比较溶液的褪色时间,高锰酸钾酸性溶液的浓度应一致,H2C2O4溶液的浓度应不同;
(3)①在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,据此写出离子方程式;
②从HC2O4-电离程度和水解程度分析;
(4)根据浓度、温度、催化剂对化学反应速率的影响分析.
解答:
解:(1)要得出反应物浓度、温度、催化剂对反应速率影响的结论至少要完成:①取不同浓度KMnO4溶液,在相同温度下进行反应;②取同浓度KMnO4溶液,在不同温度下进行反应;③取同浓度KMnO4溶溶,在同温度且有催化剂的条件下进行反应;④取同浓度KMnO4溶液,在同温度且不使用催化剂的条件下进行反应等3个实验来进行对比.
故答案为:4;
(2)①反应开始时:c(KMnO4)=
=0.0013 mol?L-1,反应时间:△t=
min=
min,KMnO4的平均反应速率:
ν(KMnO4)=
=2×10-4 mol?L-1?min-1,故答案为:2×10-4 mol?L-1?min-1;
②比较溶液的褪色时间,高锰酸钾酸性溶液的浓度应一致,因此a=0.02;H2C2O4溶液的浓度应不同,所用H2C2O4溶液的浓度可选择:0.2mol?L-1、0.4mol?L-1,因此b=0.2或0.4、c=0.4或0.2,
故答案为:0.02;0.2或0.4;0.4或0.2;
(3)①在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②HC2O4-电离使溶液呈酸性,HC2O4-水解使溶液呈碱性,室温下PH<7,溶液呈酸性,由于HC2O4-存在两步水解,因此HC2O4-电离程度大于其水解程度,
故答案为:HC2O4-电离程度大于HC2O4-水解程度;
(4)随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,温度不变对速率无影响,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,
故答案为:Mn2+对该反应起催化作用.
故答案为:4;
(2)①反应开始时:c(KMnO4)=
| 0.002mol?L-1×0.004L |
| 0.004L+0.002L |
| 6.7+6.6+6.7 |
| 3 |
| 20 |
| 3 |
ν(KMnO4)=
| 0.0013 mol?L-1 | ||
|
②比较溶液的褪色时间,高锰酸钾酸性溶液的浓度应一致,因此a=0.02;H2C2O4溶液的浓度应不同,所用H2C2O4溶液的浓度可选择:0.2mol?L-1、0.4mol?L-1,因此b=0.2或0.4、c=0.4或0.2,
故答案为:0.02;0.2或0.4;0.4或0.2;
(3)①在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②HC2O4-电离使溶液呈酸性,HC2O4-水解使溶液呈碱性,室温下PH<7,溶液呈酸性,由于HC2O4-存在两步水解,因此HC2O4-电离程度大于其水解程度,
故答案为:HC2O4-电离程度大于HC2O4-水解程度;
(4)随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,温度不变对速率无影响,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,
故答案为:Mn2+对该反应起催化作用.
点评:本题考查了外界条件的改变对化学反应速率的影响,题目难度较大,涉及对照试验涉及、化学反应速率的计算、电离和水解程度的比较等知识,注意HC2O4-存在两步水解.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列说法中,正确的是( )
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |
 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体. 通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.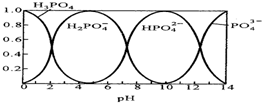 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图: