题目内容
 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.(1)从上述五种元素中,两两组合能形成多种原子数之比为1:1的化合物,请写出原子数之比为1:1的即含极性键又含非极性键的化合物的电子式
(2)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
(3)D和E非金属性较强的是(填元素符号):
(4)写出由上述三种元素形成的具漂白性的化合物的化学式
(5)用A的单质和B的单质可制成燃料电池,该电池是将多空的惰性电极浸入浓KOH溶液中,向两极分别通入A的单质和B的单质,如图所示:A的单质通入电池的
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素,则B为O元素;B、D是同主族元素,则D为S元素;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,故A、C两元素原子核内质子数之和为12,A、C是同主族元素,则A、C不会为2、3周期的同主族元素,可推知A为H,C为Na;同周期的C、D、E三种元素中,E的原子半径最小,则E为Cl,据此解答.
解答:
解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素,则B为O元素;B、D是同主族元素,则D为S元素;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,故A、C两元素原子核内质子数之和为12,A、C是同主族元素,则A、C不会为2、3周期的同主族元素,可推知A为H,C为Na;同周期的C、D、E三种元素中,E的原子半径最小,则E为Cl,
(1)上述五种元素中,两两组合形成原子数之比为1:1的即含极性键又含非极性键的化合物为H2O2,分子中O原子之间形成1对共用电子对、O原子与H原子之间形成1对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(2)H、O、Na三种元素组成的化合物为NaOH,将氯气通入NaOH的水溶液中,反应的离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-,故答案为:Cl2+2OH-=H2O+Cl-+ClO-;
(3)同周期随原子序数增大非金属性增强,故非金属性Cl>S,故答案为:Cl;
(4)由上述三种元素形成的具漂白性的化合物为HClO等,故答案为:HClO;
(5)两种均含H、O、Na、S四种元素的化合物,在溶液中相互反应且生成气体,为NaHSO3与NaHSO4反应生成硫酸钠与二氧化硫与水,反应离子方程式为:HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(6)用氢气和氧气可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液中,负极发生氧化反应,而氢气发生氧化反应,故通入氢气的电极为负极,故答案为:负;氧化.
(1)上述五种元素中,两两组合形成原子数之比为1:1的即含极性键又含非极性键的化合物为H2O2,分子中O原子之间形成1对共用电子对、O原子与H原子之间形成1对共用电子对,电子式为
 ,故答案为:
,故答案为: ;
;(2)H、O、Na三种元素组成的化合物为NaOH,将氯气通入NaOH的水溶液中,反应的离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-,故答案为:Cl2+2OH-=H2O+Cl-+ClO-;
(3)同周期随原子序数增大非金属性增强,故非金属性Cl>S,故答案为:Cl;
(4)由上述三种元素形成的具漂白性的化合物为HClO等,故答案为:HClO;
(5)两种均含H、O、Na、S四种元素的化合物,在溶液中相互反应且生成气体,为NaHSO3与NaHSO4反应生成硫酸钠与二氧化硫与水,反应离子方程式为:HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(6)用氢气和氧气可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液中,负极发生氧化反应,而氢气发生氧化反应,故通入氢气的电极为负极,故答案为:负;氧化.
点评:本题考查位置结构性质关系应用,推断元素是解答本题的关键,侧重对基础知识的巩固考查,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、用氨水溶解氯化银沉淀:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| B、碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3?H2O |
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3?H2O+H2O |
| D、二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ |



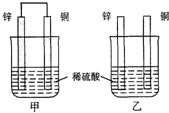 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.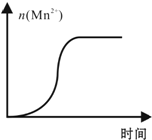 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定: