题目内容
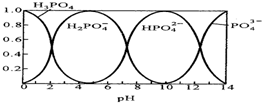 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:(1)在Na3PO4溶液中,
| c(Na+) |
| c(PO43-) |
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是
A、C(Na+)>C(H2PO4-)>C(H+)>C(HPO42-)>C(H3PO4)
B、C(Na+)>C(H2PO4-)>C(OH-)>C(H3PO4)>C(HPO42-)
C、C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4)
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4)
(3)假设25℃条件下测得0.1mol?L-1的Na3PO4溶液的pH=12,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字).
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)磷酸钠中钠离子不水解、磷酸根离子水解;向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大;
(2)NaH2PO4溶液钠离子不水解、H2PO4- 水解和电离,溶液呈酸性,溶液中存在电荷守恒和物料守恒;
(3)Kh═
.
(2)NaH2PO4溶液钠离子不水解、H2PO4- 水解和电离,溶液呈酸性,溶液中存在电荷守恒和物料守恒;
(3)Kh═
| c(HPO42-).c(OH-) |
| c(PO43-) |
解答:
解:(1)磷酸钠中钠离子不水解、磷酸根离子水解,所以
>3;向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大,所以发生的反应为 HPO42-+H+═H2PO4-,
故答案为:>;HPO42-+H+═H2PO4-;
(2)A、钠离子不水解,浓度最大,H2PO4-电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在C(Na+)>C(H2PO4-)>C(H+)>C(HPO42-)>C(H3PO4),故A正确;
B、H2PO4-电离程度大于水解程度,所以C(HPO42-)>C(H3PO4),故B错误;
C、溶液中存在电荷守恒C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-),故C错误;
D、溶液中存在物料守恒C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4),故D正确;
故选AD;
(3)PO43-+H2O?HPO42-+OH-
起始浓度(mol?L-1):0.1 0 0
变化浓度(mol?L-1):0.01 0.01 0.01
平衡浓度(mol?L-1):0.09 0.01 0.01
Kh═
=
=1.1×10 -3mol?L-1 ,
故答案为:1.1×10 -3mol?L-1 .
| c(Na+) |
| c(PO43-) |
故答案为:>;HPO42-+H+═H2PO4-;
(2)A、钠离子不水解,浓度最大,H2PO4-电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在C(Na+)>C(H2PO4-)>C(H+)>C(HPO42-)>C(H3PO4),故A正确;
B、H2PO4-电离程度大于水解程度,所以C(HPO42-)>C(H3PO4),故B错误;
C、溶液中存在电荷守恒C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-),故C错误;
D、溶液中存在物料守恒C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4),故D正确;
故选AD;
(3)PO43-+H2O?HPO42-+OH-
起始浓度(mol?L-1):0.1 0 0
变化浓度(mol?L-1):0.01 0.01 0.01
平衡浓度(mol?L-1):0.09 0.01 0.01
Kh═
| c(HPO42-).c(OH-) |
| c(PO43-) |
| 0.01×0.01 |
| 0.09 |
故答案为:1.1×10 -3mol?L-1 .
点评:本题考查了盐类水解,根据溶液中的溶质及其溶液酸碱性来分析解答,根据电荷守恒、物料守恒确定离子浓度大小,难点是水解平衡常数的计算,利用三段式法解答,题目难度中等.

练习册系列答案
相关题目
 如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)2?8H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )
如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)2?8H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )| A、该反应中,化学能转变成热能 |
| B、反应物的总能量低于生成物的总能量 |
| C、氯化铵与氢氧化钡的反应为放热反应 |
| D、反应的热化学方程式为 2NH4Cl+Ba(OH)2→BaCl2+2NH3?H2O-Q |
下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |


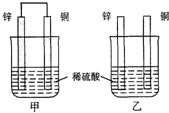 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.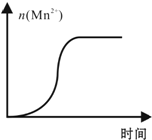 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定: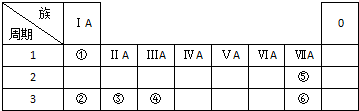 下表列出了①~⑥六种元素在周期表中的位置.
下表列出了①~⑥六种元素在周期表中的位置. 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.