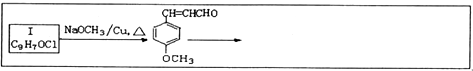
题目内容
10. A、B、C、D、E五种元素的元素序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数的2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列问题:
A、B、C、D、E五种元素的元素序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数的2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列问题:(1)基态E原子核外电子的排布式为1s22s22p63s23p63d104s1.
(2)A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为正四面体,阴离子的中心原子轨道采用sp2杂化.
(3)B、C、D三种元素的第一电离能有大到小的顺序是N>O>C(填元素符号)
(4)E(CA3)42+离子的颜色是深蓝色;含有化学键类型是共价键、配位键;该配离子中心离子的配位数为4.
(5)D、E能形成两种晶体,其晶胞分别如甲、乙两图.在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质.该化学反应方程式为4CuO+N2H4$\frac{\underline{\;一定条件\;}}{\;}$2Cu2O+2H2O+N2↑.
分析 A、B、C、D、E五种元素的原子序数依次增大,A的原子序数等于周期数,则A是H元素;B的最外层电子数是次外层电子数2倍,则B是C元素;D的L层有两对成对电子,其L层的电子排布式为:2s22p4,所以D为O元素;C的原子序数介于C、O之间,所以C为N元素;E+的核外有三个电子层,且都处于全满状态,
则E+的电子排布式为1s22s22p63s23p63d10,其原子的电子排布式为:1s22s22p63s23p63d104s1,其原子序数为29,则为Cu元素,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)A、B、C、D、E五种元素的原子序数依次增大,A的原子序数等于周期数,则A是H元素;B的最外层电子数是次外层电子数2倍,则B是C元素;D的L层有两对成对电子,其L层的电子排布式为:2s22p4,所以D为O元素;C的原子序数介于C、O之间,所以C为N元素;E+的核外有三个电子层,且都处于全满状态,
则E+的电子排布式为1s22s22p63s23p63d10,其原子的电子排布式为:1s22s22p63s23p63d104s1,其原子序数为29,则为Cu元素,
(1)基态Cu原子核外电子的排布式为1s22s22p63s23p63d104s1;
故答案为:1s22s22p63s23p63d104s1;
(2)NH4+ 的中心原子氮原子价层电子对数=$\frac{5+4-1}{2}$=4,孤电子对=$\frac{5-1×4-1}{2}$=0,所以NH4+ 的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=$\frac{5+1}{2}$=3,所以氮原子按sp2方式杂化,
故答案为:正四面体;sp2;
(3)同周期自左而右第一电离能增大,但N原子最外层为半充满结构,第一电离能大于O,应为N>O>C,
故答案为:N>O>C;
(4)铜离子与氨气结合生成Cu(NH3)42+离子,铜氨络离子显深蓝色,Cu(NH3)42+中铜离子与氨气之间形成4个配位键,N与H形成共价键;
故答案为:深蓝色;共价键、配位键;4;
(5)O、Cu形成的化合物,晶胞甲中,白色球数目=1+8×$\frac{1}{8}$+2×$\frac{1}{2}$+4×$\frac{1}{4}$=4,黑色球数目为4,故该晶体中Cu、O原子数目之比为1:1,该化合物为CuO;晶胞乙中白色球数目=1+8×$\frac{1}{8}$=2,黑色球数目为4,为A2B型,故该化合物化学式为Cu2O;在一定条件下,CuO和N2H4反应生成Cu2O,同时生成在常温下分别为气体和液体的另外两种常见无污染物质,由元素守恒可知,生成氮气和水,则反应方程式为:4CuO+N2H4$\frac{\underline{\;一定条件\;}}{\;}$2Cu2O+2H2O+N2↑,
故答案为:4CuO+N2H4$\frac{\underline{\;一定条件\;}}{\;}$2Cu2O+2H2O+N2↑.
点评 本题考查了元素位置结构性质的相互关系及应用,根据原子结构、电子排布式、元素周期表结构确定元素,再结合物质的性质来分析解答,正确推断元素是解本题关键根据,题目难度中等.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
| A. | Na2O+H2O═2NaOH | B. | Cl2+H2O═HCl+HClO | ||
| C. | H2SO4+Na2SO3=Na2SO4+SO2↑+H2O | D. | FeS+2HCl═FeCl2+H2S↑ |
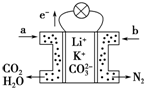 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | a为C4H10,b为CO2 | |
| B. | 在熔融电解质中,CO32-向正极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10-26e-+13CO32-=17CO2↑+5H2O |
| A. | 原子半径大小顺序:D>C>B>A | |
| B. | y、p 中均只含有离子键 | |
| C. | B、D两元素最高价氧化物对应水化物分别为强酸、强碱 | |
| D. | p能抑制水的电离而q能促进水的电离 |
| A. | 石灰水、水 | B. | 干冰、冰水混合物 | ||
| C. | 石墨、铁矿石 | D. | 不锈钢菜刀、食用醋 |
| 项 目 | 每100克(g) | 营养素参考值% |
| 能 量 | 1500kJ | 18% |
| 蛋 白 质 | 0g | 0% |
| 脂 肪 | 2.0g | 3% |
| 碳水化合物 | 72g | 24% |
| 钠 | 30mg | 2% |
(1)在六大基本营养素中,除水之外,上表中没有列出的是维生素;
(2)表中的“钠”是指钠元素,
(3)服用蜂蜜可有效补充人体所需能量,其中提供能量的主要是碳水化合物(或糖类).
(4)麦芽糖(C12H22O11)是蜂蜜中的一种碳水化合物,它在一定条件下可实现如下转化:C12H22O11+X═2C6H12O6,X的化学式为H2O,反应类型是化合反应.
| A. | 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 | |
| B. | 元素Y能与元素Z形成化合物Z2Y2,该化合物内部有两种化学键 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR,沸点XmY<XmR | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |


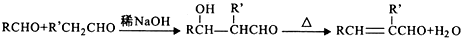
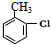 ,H→I两步反应的反应类型加成反应、消去反应.
,H→I两步反应的反应类型加成反应、消去反应.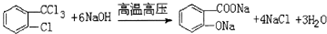 ,E→F
,E→F