题目内容
3.金属腐蚀的现象非常普遍.造成钢铁腐蚀的主要原因是电化学腐蚀,其负极反应式为Fe-2e-=Fe2+.分析 钢铁在强、弱酸性或中性条件下都发生电化学腐蚀,所以造成钢铁腐蚀的主要原因是电化学腐蚀,钢铁腐蚀电化学腐蚀时都是Fe作负极,铁失电子发生氧化反应,据此分析解答.
解答 解:钢铁在强、弱酸性或中性条件下都发生电化学腐蚀,所以造成钢铁腐蚀的主要原因是电化学腐蚀,钢铁腐蚀电化学腐蚀时都是Fe作负极,铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,故答案为:电化学;Fe-2e-=Fe2+.
点评 本题考查以钢铁的电化学腐蚀为载体考查电极反应式的书写,为高频考点,钢铁发生析氢腐蚀或吸氧腐蚀时都是Fe作负极,负极反应式相同,但正极反应式不同,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g | |
| C. | 等体积等密度的N2和CO所含分子数相同 | |
| D. | 含NA个Na+的Na2O溶解于水1L水中,Na+的物质的量浓度为1mol•L-1 |
14.38.4g铜跟适量的浓HNO3反应,铜全部作用后,共收集到气体22.4L(标准状况下),反应消耗的HNO3的物质的量可能是( )
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
18.糖类是由C、H、O三种元素组成的一类有机化合物.最重要、最简单的单糖是葡萄糖,葡萄糖具有还原性(填还原或者氧化),能和银氨溶液反应产生银镜;淀粉和纤维素都是重要的多糖,它们最终水解产物是葡萄糖.
15.沼气是一种能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和H2O时,放出445kJ的热量.则下列热化学方程式中正确的是( )
| A. | 2CH4( g )+4O2( g )═2CO2( g )+4H2O ( l )△H=+890 kJ/mol | |
| B. | CH4+2O2═CO2+H2O△H=-890 kJ/mol | |
| C. | CH4 ( g )+2 O2 ( g )═CO2 ( g )+2 H2O ( l )△H=-890 kJ/mol | |
| D. | $\frac{1}{2}$CH4 ( g )+O2 ( g )═$\frac{1}{2}$CO2 ( g )+H2O ( l )△H=-890 kJ/mol |
12.随着公路上汽车流量的迅速增长,交通事故频繁发生.汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞时发生反应:10NaN3+2KNO3→K2O+5Na2O+16N2↑.下列判断正确的是( )
| A. | N2既是氧化剂又是还原剂 | |
| B. | NaN3中N元素被还原 | |
| C. | 还原产物与氧化产物质量之比为l:15 | |
| D. | 每生成16molN2转移30mole |
13.醛可发生分子间的反应,生成烃基醛,如
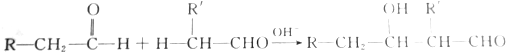
现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
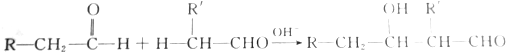
现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
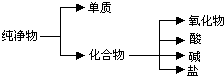 (1)纯净物根据其组成和性质可进行如图分类:
(1)纯净物根据其组成和性质可进行如图分类: