题目内容
12.0.3mol硫化亚铜跟适量硝酸恰好完全反应.反应方程式为:3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O,则反应中未被还原的硝酸的物质的量为( )| A. | 2.2mol | B. | 1.2mol | C. | 0.6mol | D. | 1.0mol |
分析 3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O,在该反应中未被还原的硝酸为生成Cu(NO3)2的硝酸,根据原子守恒分析解答.
解答 解:根据题意知,3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O,在该反应中未被还原的硝酸为生成Cu(NO3)2的硝酸,根据原子守恒得Cu2S---2Cu---Cu(NO3)2---2HNO3,所以未被还原硝酸的物质的量=0.3mol×2×2=1.2mol,
故选B.
点评 本题考查了物质的量的计算,难度不大,明确未被还原的硝酸生成硝酸盐是解本题关键,结合原子守恒来分析解答.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
2.王奶奶最近因身体不适去医院做了体检,得到的血液化验单中标有葡萄糖5.9×10-3mol•L-1,正常值为3.9~6.1×10-3mol•L-1.表示该体检指标的物理量是( )
| A. | 溶解度(s) | B. | 物质的量浓度(c) | C. | 质量分数(w) | D. | 摩尔质量(M) |
20.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA | |
| D. | 在反应KI03+6HI=KI+3I2+3H20中,每生成3 mol I2转移的电子数为6 NA |
4.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2═2Fe2++4OH-.说法正确的是( )
| A. | 负极发生的反应为:Fe-3e-═Fe3+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 钢柱在水下部分比在空气与水交界处更难腐蚀 |
2.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在常温常压下,11.2 L氧气所含的分子数为0.5NA | |
| B. | 在常温常压下,1molHe的体积为22.4 L | |
| C. | 32 g氧气所含的原子数目为2NA | |
| D. | 在同温同压下,相同体积的任何气体所含的原子数相等 |
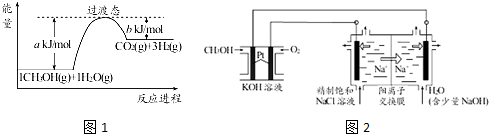

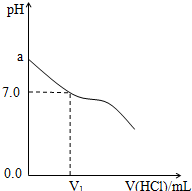 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的Ph值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的Ph值的变化关系如图所示.