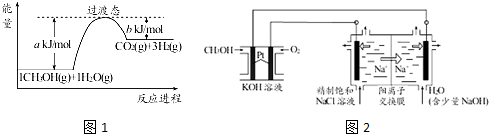
题目内容
15.酒石酸(tartaric acid),即2,3-二羟基丁二酸,是一种羧酸﹐存在于多种植物中,也是葡萄酒中主要的有机酸之一.作为食品中添加的抗氧化剂﹐可以使食物具有酸味.酒石酸最大的用途是饮料添加剂,也是药物工业原料,以烃A为原料合成酒石酸的流程如下: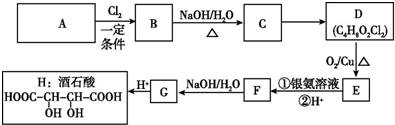
已知:①烃A中碳氢质量比为8:1
②
 +Cl3$\stackrel{一定条件}{→}$
+Cl3$\stackrel{一定条件}{→}$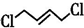
③D的分子组成是C4H8O2Cl2,核磁共振氢谱显示其有三个峰.
(1)A的名称为1,3-丁二烯,分子中最多有10个原子共面;
(2)B中所含官能团的名称是碳碳双键、氯原子,B存在顺反异构,它的顺式结构为
 ;
;(3)C转化为D的反应类型是加成反应,F转化为G的化学反应方程式是
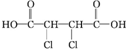 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$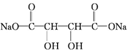 +2NaCl+2H2O;
+2NaCl+2H2O;(4)F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是
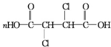 +n
+n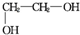 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$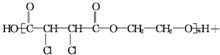
(2n-1)H2O;
(5)C的同分异构体有多种,其中含有“-COO-”结构的有6种;
(6)欲得到较纯净的酒石酸,需将G从其溶液中分离提纯,查阅相关资料得知G的溶解度受温度影响较大,则分离提纯G的方法是重结晶.
分析 烃A中碳氢质量比为8:1,则A中C、H的原子个数比为2:3,所以A的分子式为C4H6,A与氯气发生信息中的加成反应生成B,B在碱性条件下水解得C为醇,根据D的分子式可知,C与氯气发生加成反应生成D,D核磁共振氢谱显示其有三个峰,D发生氧化反应得E,E发生氧化反应得F,F再发生水解得G,G酸化得H,根据H的结构简式可以反应推得G为NaOOCCHOHCHOHCOONa,F为HOOCCHClCHClCOOH,E为OHCCHClCHClCHO,D为HOCH2CHClCHClCH2OH,C为HOCH2CH=CHCH2OH,B为ClCH2CH=CHCH2Cl,A为CH2=CHCH=CH2,据此分析解答.
解答 解:烃A中碳氢质量比为8:1,则A中C、H的原子个数比为2:3,所以A的分子式为C4H6,A与氯气发生信息中的加成反应生成B,B在碱性条件下水解得C为醇,根据D的分子式可知,C与氯气发生加成反应生成D,D核磁共振氢谱显示其有三个峰,D发生氧化反应得E,E发生氧化反应得F,F再发生水解得G,G酸化得H,根据H的结构简式可以反应推得G为NaOOCCHOHCHOHCOONa,F为HOOCCHClCHClCOOH,E为OHCCHClCHClCHO,D为HOCH2CHClCHClCH2OH,C为HOCH2CH=CHCH2OH,B为ClCH2CH=CHCH2Cl,A为CH2=CHCH=CH2,
(1)A为CH2=CHCH=CH2,A中有两个碳碳双键结构,分子中所有原子都可能共面,共有10个原子,
故答案为:CH2=CHCH=CH2;10;
(2)B为ClCH2CH=CHCH2Cl,B中所含官能团的名称是碳碳双键、氯原子,B存在顺反异构,它的顺式结构为 ,
,
故答案为:碳碳双键、氯原子; ;
;
(3)通过以上分析知,C发生加成反应生成D,F和NaOH反应方程式为 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$ +2NaCl+2H2O,
+2NaCl+2H2O,
故答案为:加成反应; +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$ +2NaCl+2H2O;
+2NaCl+2H2O;
(4)F为HOOCCHClCHClCOOH,F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是 +n
+n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$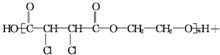
(2n-1)H2O,
故答案为: +n
+n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$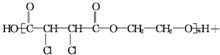
(2n-1)H2O;
(5)C为HOCH2CH=CHCH2OH,C的同分异构体有多种,其中含有“-COO-”结构有HCOOCH2CH2COOH、(CH3)2CHCOOH、HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3,所以符合条件的有6种,
故答案为:6;
(6)因为NaOOCCHOHCHOHCOONa的溶解度受温度影响较大,所以分离提纯NaOOCCHOHCHOHCOONa的方法是重结晶,
故答案为:重结晶.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系及常见反应条件、反应类型是解本题关键,难点是同分异构体种类判断,题目难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 恒容密闭容器中进行的反应3A(g)?B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 | |
| B. | 对于可逆反应N2(g)+3H2(g)?2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 | |
| C. | 将FeCl3溶液和NaAlO2溶液相混,所得固体产物Fe(OH)3 | |
| D. | 反应NH3(g)+HCl(g)?NH4Cl(s)△H<O在任何条件下均能自发进行 |
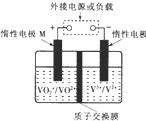 全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 充电过程中,N电极附近酸性减弱 | |
| B. | 充电过程中,N电极上V3+被还原为V2+ | |
| C. | 放电过程中,H+由N电极向M电极移动 | |
| D. | 放电过程中,M电极反应为V02++2H++e-═V02++H20 |
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA | |
| D. | 在反应KI03+6HI=KI+3I2+3H20中,每生成3 mol I2转移的电子数为6 NA |
| A. | 负极发生的反应为:Fe-3e-═Fe3+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 钢柱在水下部分比在空气与水交界处更难腐蚀 |
| A. | △H1>△H2>△H3 | B. | △H1<△H3<△H2 | C. | △Hl<△H2<△H3 | D. | △H1>△H3>△H2 |