题目内容
19.反应CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0,达到平衡时,下列说法正确的是( )| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 保持容积不变,增大CO2的量,NH3的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
分析 A.催化剂改变化学反应速率,不改变化学平衡;
B.减小容器体积相当于增大压强,反应速率增大;
C.增加二氧化碳,平衡正向移动;
D.反应是放热反应,降低温度,平衡正向进行.
解答 解:A.催化剂改变化学反应速率,不改变化学平衡,加入催化剂,平衡常数不变,故A正确;
B.减小容器体积相当于增大压强,反应速率增大,正逆反应速率都增大,故B错误;
C.增加二氧化碳,平衡正向移动,NH3的转化率增大,故C错误;
D.依据化学平衡移动原理分析,反应是放热反应,降低温度,平衡正向进行,故D错误;
故选A.
点评 本题考查了化学平衡影响因素分析判断,为高频考点,侧重于学生的分析能力的考查,题目涉及平衡移动原理的理解应用,注意反应特征的方向,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列各组能源中,前者是化石能源,后者是新能源的是( )
| A. | 氢气、天然气 | B. | 液化气、核能 | C. | 太阳能、风能 | D. | 燃煤、97#汽油 |
10.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1 mol H2O中所含的粒子数目一定是NA | |
| B. | 1 molNH4+所含的质子数是10NA | |
| C. | 51 g NH3所含原子数为3NA | |
| D. | 氧气的相对分子质量与2NA个氧原子质量(以g为单位)在数值上相等 |
14.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )
| A. |  | B. |  | C. |  | D. |  |
11.下列除杂方法不正确的是( )
| A. | 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH | |
| B. | 除去金属离子Cu2+、Hg2+,可向溶液中加入H2S、Na2S等沉淀剂 | |
| C. | 除去某溶液中的SO42-可向溶液中加入镁盐 | |
| D. | 除去ZnCl2溶液中的Fe3+可向溶液中加入ZnO |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA | |
| B. | 1 mol-OH中电子数为10 NA | |
| C. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| D. | 常温常压下,28 g丙烯和丁烯的混合气体中含有的碳原子数为2 NA |
12.下列实验操作错误的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
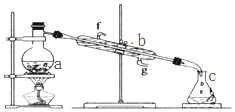 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.