题目内容
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、46g NO2含有NA个NO2分子 |
| B、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
| C、标准状况下,NA个CO2分子所占的体积约为22.4 L |
| D、1mol Al3+离子含有的核外电子数为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、二氧化氮存在转化平衡:N2O4?2NO2,46g二氧化氮中含有的分子数小于1mol;
B、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,10L该溶液中含有1mol氢离子;
C、NA个CO2分子的物质的量为1mol,标准状况下,1mol二氧化碳的体积约为22.4L;
D、铝离子核外含有10个电子,1mol铝离子含有10mol电子.
B、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,10L该溶液中含有1mol氢离子;
C、NA个CO2分子的物质的量为1mol,标准状况下,1mol二氧化碳的体积约为22.4L;
D、铝离子核外含有10个电子,1mol铝离子含有10mol电子.
解答:
解:A、46g二氧化氮的物质的量为1mol,由于二氧化氮与四氧化二氮存在转化平衡:N2O4?2NO2,所以混合物中含有的二氧化氮的物质的量小于1mol,分子数小于NA,故A错误;
B、10L pH=1的硫酸溶液中氢离子浓度为1mol/L,溶液中含有1mol氢离子,含有的H+离子数为NA,故B错误;
C、NA个CO2分子的物质的量为1mol,标况下,1mol二氧化碳的体积约为22.4L,故C正确;
D、1mol铝离子核外电子的物质的量为10mol,核外电子数为10NA,故D错误;
故选C.
B、10L pH=1的硫酸溶液中氢离子浓度为1mol/L,溶液中含有1mol氢离子,含有的H+离子数为NA,故B错误;
C、NA个CO2分子的物质的量为1mol,标况下,1mol二氧化碳的体积约为22.4L,故C正确;
D、1mol铝离子核外电子的物质的量为10mol,核外电子数为10NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确二氧化氮与四氧化二氮之间的转化平衡;注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
NA表示阿伏加德罗常数的值.下列说法中,正确的是( )
| A、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
| B、电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 |
| C、向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,转移电子的数目为0.5NA |
| D、将100 mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.2NA |
| B、常温常压下,18gH2O中含的质子数为10NA |
| C、标准状况下,11.2LCH2Cl2中含有的分子数目为0.5NA |
| D、常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
下列有关叙述正确的是( )
A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH
| ||
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | ||
C、室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中
| ||
| D、在0.1 mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)?2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol?L-1 | 0.08 | a | b |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、平衡时,X的转化率为20% |
| B、t℃时,该反应的平衡常数为40 |
| C、增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
| D、前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol?L-1?min-1 |
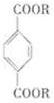 某种对苯二甲酸酯常用作塑料增塑剂,其结构简式如图所示.(R表示相同的烃基)
某种对苯二甲酸酯常用作塑料增塑剂,其结构简式如图所示.(R表示相同的烃基)


