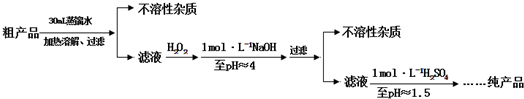
题目内容
将8.4克小苏打(NaHCO3)投入盐酸中二者恰好完全反应,问生成多少个水分子?生成多少升标况下的二氧化碳气体?生成多少摩尔食盐?耗0.1mol/L的盐酸多少升?
考点:化学方程式的有关计算
专题:计算题
分析:发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,根据方程式计算生成H2O、CO2、NaCl的物质的量,计算消耗HCl的物质的量,再根据N=nNA计算生成H2O分子数目,根据V=nVm计算二氧化碳体积,根据V=
计算消耗盐酸的体积.
| n |
| c |
解答:
解:8.4gNaHCO3的物质的量=
=0.1mol,则:
NaHCO3+HCl=NaCl+CO2↑+H2O
1 1 1 1 1
0.1mol 0.1mol 0.1mol 0.1mol 0.1mol
故生成H2O分子数目=0.1mol×NAmol-1=0.1NA,
生成二氧化碳的体积=0.1mol×22.4L/mol=2.24L,
生成NaCl的物质的量为0.1mol,
消耗HCl的物质的量为0.1mol,故消耗盐酸的体积=
=1L,
答:生成H2O分子数目为0.1NA,生成二氧化碳的体积为2.24L,生成NaCl的物质的量为0.1mol,消耗盐酸的体积为1L.
| 8.4g |
| 84g/mol |
NaHCO3+HCl=NaCl+CO2↑+H2O
1 1 1 1 1
0.1mol 0.1mol 0.1mol 0.1mol 0.1mol
故生成H2O分子数目=0.1mol×NAmol-1=0.1NA,
生成二氧化碳的体积=0.1mol×22.4L/mol=2.24L,
生成NaCl的物质的量为0.1mol,
消耗HCl的物质的量为0.1mol,故消耗盐酸的体积=
| 0.1mol |
| 0.1mol/L |
答:生成H2O分子数目为0.1NA,生成二氧化碳的体积为2.24L,生成NaCl的物质的量为0.1mol,消耗盐酸的体积为1L.
点评:本题考查根据方程式进行的计算,比较基础,注意掌握常用化学计量数的有关计算.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
已知几种难溶电解质的溶度积常数Ksp(25℃)见下表:
下列叙述不正确的是( )
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A、Ksp的大小与三种卤化银见光分解的难易无关 |
| B、将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生 |
| C、向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液 |
| D、向100 mL 0.1mol?L-1的Na2SO4溶液中加入1 mL 0.1 mol?L-1的AgNO3溶液,有白 色沉淀生成 |
对如图的锌锰电池,下列说法正确的是( )
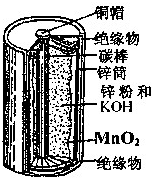

| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、46g NO2含有NA个NO2分子 |
| B、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
| C、标准状况下,NA个CO2分子所占的体积约为22.4 L |
| D、1mol Al3+离子含有的核外电子数为3NA |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4L二氯甲烷含有NA个二氯甲烷分子 |
| B、1L 0.1mol/L乙酸溶液中H+数为0.1NA |
| C、17.6g丙烷中所含的极性共价键为3.2NA个 |
| D、1mol Na2O2 固体中含离子总数为4NA |