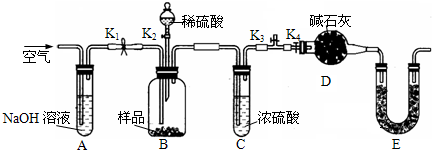
题目内容
下列有关叙述正确的是( )
A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH
| ||
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | ||
C、室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中
| ||
| D、在0.1 mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、根据电荷守恒分析;
B、根据一元酸的酸性强弱分析;
C、根据影响Kw和Ka的因素分析;
D、根据质子守恒分析.
B、根据一元酸的酸性强弱分析;
C、根据影响Kw和Ka的因素分析;
D、根据质子守恒分析.
解答:
解:A、氨水与氯化铵的pH=7的混合溶液中,存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),已知pH=7,则c(Cl-)=c(NH4+),故A错误;
B、pH=2的一元酸,若为弱酸,则c(酸)>10-2mol/L,若为强酸,则c(酸)=10-2mol/L,所以混合后可能显酸性或中性,故c(H+)≥c(OH-),故B错误;
C、室温下向10 mL pH=3的醋酸溶液中加水稀释,Kw和Ka不变,所以溶液中
=
不变,故C正确;
D、在0.1 mol?L-1的硫化钠溶液中,存在质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选C.
B、pH=2的一元酸,若为弱酸,则c(酸)>10-2mol/L,若为强酸,则c(酸)=10-2mol/L,所以混合后可能显酸性或中性,故c(H+)≥c(OH-),故B错误;
C、室温下向10 mL pH=3的醋酸溶液中加水稀释,Kw和Ka不变,所以溶液中
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
| Ka |
| Kw |
D、在0.1 mol?L-1的硫化钠溶液中,存在质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选C.
点评:本题考查了溶液中的电荷守恒、质子守恒的应用,酸碱混合,Ka和Kw的应用,题目难度中等.

练习册系列答案
相关题目
对如图的锌锰电池,下列说法正确的是( )
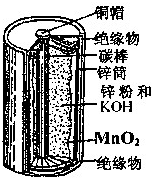

| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、46g NO2含有NA个NO2分子 |
| B、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
| C、标准状况下,NA个CO2分子所占的体积约为22.4 L |
| D、1mol Al3+离子含有的核外电子数为3NA |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++CO32-+H2O→Cu(OH)2↓+CO2↑次要:Cu2++CO32-→CuCO3↓
(2)CuSO4+Na2S主要:Cu2++S2-→CuS↓次要:Cu2++S2-+2H2O→Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
(1)CuSO4+Na2CO3主要:Cu2++CO32-+H2O→Cu(OH)2↓+CO2↑次要:Cu2++CO32-→CuCO3↓
(2)CuSO4+Na2S主要:Cu2++S2-→CuS↓次要:Cu2++S2-+2H2O→Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
| A、Cu(OH)2>CuCO3>CuS |
| B、CuS>Cu(OH)2>CuCO3 |
| C、CuS<Cu(OH)2<CuCO3 |
| D、Cu(OH)2<CuCO3<CuS |
已知AgI为黄色沉淀,AgCl为白色沉淀.25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol?L-1,AgCI饱和溶液中c(Ag+)为1.30×10-5mol?L-1.若在5mL含有KC1和KI浓度均为0.01mol?L-1的混合溶液中,滴加8mL0.0l mol?L-1的AgNO3溶液,则下列叙述中不正确的是( )
| A、溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀会转变成白色沉淀 |
室温时,在0.1mol?L-1的NH3?H2O溶液中,要促进氨水电离,且氢氧根离子浓度增大,应采取的措施是( )
| A、升温至30℃ |
| B、降温 |
| C、加入NaOH溶液 |
| D、加入稀HCl |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4L二氯甲烷含有NA个二氯甲烷分子 |
| B、1L 0.1mol/L乙酸溶液中H+数为0.1NA |
| C、17.6g丙烷中所含的极性共价键为3.2NA个 |
| D、1mol Na2O2 固体中含离子总数为4NA |