题目内容
NA表示阿伏加德罗常数的值.下列说法中,正确的是( )
| A、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA |
| B、电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 |
| C、向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,转移电子的数目为0.5NA |
| D、将100 mL0.1mol?L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据化学方程式中元素化合价变化分析计算转移电子数;
B、依据电解精炼粗铜做阳极,精铜做阴极和电子守恒计算分析判断;
C、依据氧化还原反应过程,离子物质的量和氧化还原反应顺序进行分析计算;
D、氢氧化铁胶粒是氢氧化铁的微粒集合体;
B、依据电解精炼粗铜做阳极,精铜做阴极和电子守恒计算分析判断;
C、依据氧化还原反应过程,离子物质的量和氧化还原反应顺序进行分析计算;
D、氢氧化铁胶粒是氢氧化铁的微粒集合体;
解答:
解:A、在反应KIO3+6HI═KI+3I2+3H2O中,依据碘元素化合价变化分析,每生成3molI2转移的电子数为5NA,故A错误;
B、电解精炼铜时,电解精炼粗铜做阳极,精铜做阴极和电子守恒,当电路中转移NA个电子,阳极溶解的除铜外还有锌、镍等金属,所以溶解的铜质量小于32g铜,故B错误;
C、向仅含0.2molFeI2的溶液中持续通入氯气,氧化还原反应反应顺序进行,2I-+Cl2=I2+2Cl-,2Fe2++Cl2=2Fe3++2Cl-,当有0.1molFe2+被氧化时,碘离子全部被氧化,转移电子的数目为0.5NA,故C正确;
D、将100 mL0.1mol?L-1的FeCl3溶液滴入沸水中,氢氧化铁胶粒是氢氧化铁的微粒集合体,可制得Fe(OH)3胶粒小于0.01NA,故D错误;
故选C.
B、电解精炼铜时,电解精炼粗铜做阳极,精铜做阴极和电子守恒,当电路中转移NA个电子,阳极溶解的除铜外还有锌、镍等金属,所以溶解的铜质量小于32g铜,故B错误;
C、向仅含0.2molFeI2的溶液中持续通入氯气,氧化还原反应反应顺序进行,2I-+Cl2=I2+2Cl-,2Fe2++Cl2=2Fe3++2Cl-,当有0.1molFe2+被氧化时,碘离子全部被氧化,转移电子的数目为0.5NA,故C正确;
D、将100 mL0.1mol?L-1的FeCl3溶液滴入沸水中,氢氧化铁胶粒是氢氧化铁的微粒集合体,可制得Fe(OH)3胶粒小于0.01NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是氧化还原反应电子转移计算方法,氧化还原反应顺序进行的分析应用,电解精炼原理理解,胶体微粒形成的应用判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
已知几种难溶电解质的溶度积常数Ksp(25℃)见下表:
下列叙述不正确的是( )
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A、Ksp的大小与三种卤化银见光分解的难易无关 |
| B、将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生 |
| C、向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液 |
| D、向100 mL 0.1mol?L-1的Na2SO4溶液中加入1 mL 0.1 mol?L-1的AgNO3溶液,有白 色沉淀生成 |
下列事实可证明氨水中的(NH3?H2O)是弱碱的是( )
| A、氨水能被弱酸醋酸中和 |
| B、铵盐受热易分解 |
| C、氨水可以使酚酞试液变红 |
| D、常温下,0.1mol/L氯化铵溶液的pH约为5 |
已知Ksp(AgC1)=1.8×10-10mol2?L-2,Ksp(AgI)=1.0×1016mo2?L-2.下列说法错误的是( )
| A、AgCl不溶于水,不能转化为AgI | ||||
| B、在含浓度均为0.001mol?L-1的Cl-、I-的溶液中缓慢滴AgNO3稀溶液,先析出AgI | ||||
| C、AgI比AgCl更难溶于水,所以AgCl可转化为AgI | ||||
D、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
|
下列操作或仪器的选用正确的是( )
A、 滴定NaOH溶液 |
B、 制取氧气 |
C、 制备Fe(OH)2 |
D、 除去乙醇中的乙酸 |
对如图的锌锰电池,下列说法正确的是( )
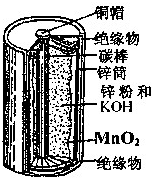

| A、MnO2是氧化剂,被氧化 |
| B、碳棒为负极、锌筒为正极 |
| C、放电过程中NH4+向锌极移动 |
| D、负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、46g NO2含有NA个NO2分子 |
| B、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
| C、标准状况下,NA个CO2分子所占的体积约为22.4 L |
| D、1mol Al3+离子含有的核外电子数为3NA |