题目内容
7.Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1gNa2SO3溶于80.0mL水.另取5.0g硫粉,用少许乙醇润湿后加到上述溶液中.
小火加热至微沸,反应1小时后过滤.滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3•5H2O.
(1)加入的硫粉用乙醇润湿的目的是有利于硫粉和Na2SO3溶液充分接触,加快反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是Na2SO4;
(3)某环境监测小组用含0.100mol•L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3):n(Na2SO3)=
5:1]测定某工厂废水中Ba2+的浓度.他们取废水50.0mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.00mL.
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
②I2+2S2O32-═2I-+S4O62-;③I2+SO32-+H2O═2I-+SO42-+2H+)
则滴定过程中可用淀粉作指示剂;滴定终点的现象蓝色褪去半分钟不变化.
计算该工厂废水中Ba2+的物质的量浓度.(写出计算过程)溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,
n(Na2S2O3)=0.0360 L×0.100 mol•L-1=0.0036 mol,则n(Na2SO3)=0.00360 mol×$\frac{1}{5}$=0.00072 mol
根据题意:2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-
2 6
n1 0.0036 mol
得n1(Ba2+)=$\frac{0.0036mol×2}{6}$=0.0012 mol
2Ba2+~2BaCrO4~Cr2O72-~3I2~3SO32-
2 3
n2 0.00072mol
得得n2(Ba2+)=$\frac{0.00072mol×2}{3}$=0.00048 mol
则c(Ba2+)=$\frac{0.0012mol+0.00048mol}{0.05L}$=3.36×10-2 mol•L-1.
分析 (1)硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中;
(2)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;
(3)生成的碘单质遇到淀粉变蓝,用硫代硫酸钠滴定时,当蓝色褪去半分钟不变化,说明反应达到终点;溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,根据方程式列出各物质的关系为2Ba2+~2BaCrO4~Cr2O72-~3 I2~6S2O32-和2BaCrO4~Cr2O72-~3I2~3SO32-计算.
解答 解:(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率,
故答案为:使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率;
(2)S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠,
故答案为:Na2SO4;
(3)依据标定的原理可知,生成的碘单质遇到淀粉变蓝,用硫代硫酸钠滴定当蓝色褪去半分钟不变化,说明反应达到终点;溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,
n(Na2S2O3)=0.0360 L×0.100 mol•L-1=0.0036 mol,则n(Na2SO3)=0.00360 mol×$\frac{1}{5}$=0.00072 mol
根据题意:2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-
2 6
n1 0.0036 mol
得n1(Ba2+)=$\frac{0.0036mol×2}{6}$=0.0012 mol
2Ba2+~2BaCrO4~Cr2O72-~3I2~3SO32-
2 3
n2 0.00072mol
得得n2(Ba2+)=$\frac{0.00072mol×2}{3}$=0.00048 mol
则c(Ba2+)=$\frac{0.0012mol+0.00048mol}{0.05L}$=3.36×10-2 mol•L-1,
答:淀粉;蓝色褪去半分钟不变化;溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,
n(Na2S2O3)=0.0360 L×0.100 mol•L-1=0.0036 mol,则n(Na2SO3)=0.00360 mol×$\frac{1}{5}$=0.00072 mol
根据题意:2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-
2 6
n1 0.0036 mol
得n1(Ba2+)=$\frac{0.0036mol×2}{6}$=0.0012 mol
2Ba2+~2BaCrO4~Cr2O72-~3I2~3SO32-
2 3
n2 0.00072mol
得得n2(Ba2+)=$\frac{0.00072mol×2}{3}$=0.00048 mol
则c(Ba2+)=$\frac{0.0012mol+0.00048mol}{0.05L}$=3.36×10-2 mol•L-1;
点评 本题考查了试剂的作用、物质的推断、滴定的计算、方程式的书写等知识,(3)计算量较大,题目难度较大,注意关系式的应用.

| A. | 氧化产物是O2 | |
| B. | BrF3既是氧化剂又是还原剂 | |
| C. | 当有5mol水参加反应,生成22.4L氧气 | |
| D. | 当反应中转移3NA个电子时,有NA个水分子被氧化 |
 “摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )
“摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,钴的化合价升高 | |
| C. | 充电时,阴极的质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-═Na1-xCoO2+xNa+ |
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、NH4+、Br- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 1.0 mol•L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
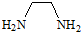 )在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )
)在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )| A. | C10H16N2O8 | B. | C10H20N2O8 | C. | C8H16N2O8 | D. | C16H20N2O8Cl |

| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |